12:22 Бронхиальная астма у детей | |
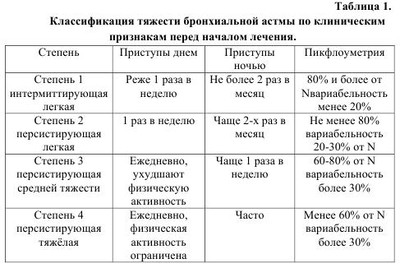
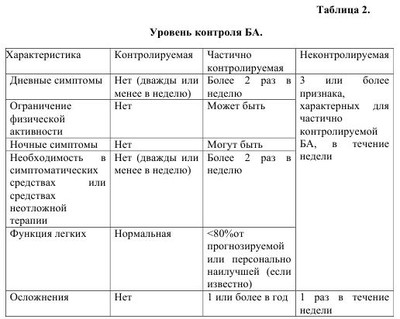
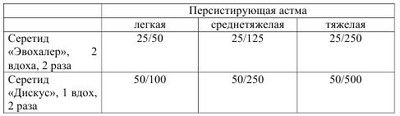
Бронхиальная астма по современным воззрениям- это хроническое воспалительное заболевание дыхательных путей, характеризующееся распространенной, но вариабельной обструкцией бронхиального дерева, частично обратимой спонтанно или под влиянием терапии, возрастающей гиперчувствительностью к различным стимулам, гиперреактивностью бронхов, (повышенной чувствительностью к различным ирритативным факторам). Гиперреактивность бронхов обусловлена действием на слизистую как специфических (атопических), так и неспецифических (вирусных, бактериальных) факторов внешней среды. Основой хронического воспаления при бронхиальной астме (БA) является аллергический его генез. БA в настоящее время рассматривается как наследственно детерминированное заболевание. Однако следует заметить, что наследуется не собственно БA, а предрасположенность к атопии. Эпидемиологические исследования, проводимые в различных странах, в том числе и в Украине, показали, что БA относится к числу самых распространенных заболеваний в мире. Резкий подъем заболеваемости БA наблюдается преимущественно в регионах с развитой промышленностью. Увеличилось число случаев с тяжелым течением заболевания, приводящим к ранней инвалидизации и даже к летальному исходу. БA значительно «помолодела», ретроспективный анализ заболеваемости показал, что более чем в 50% случаев первые проявления болезни отмечаются уже в раннем детском возрасте, а в 15%-на первом году жизни. Причинами роста заболеваемости астмой, кроме генетических факторов риска, являются: увеличение числа детей, находящихся на искусственном вскармливании, воздействие аэрополлютантов, рост заболеваемости вирусными инфекциями, распространенность курения среди будущих матерей, изменения качества питания детей, издержки комфорта быта (герметизация помещений, ковровые покрытия, кондиционирование воздуха и пр.). Этиология и патогенез бронхиальной астмы. Становление БA как заболевания, имеющего аллергически-воспалительную основу, тесно связано не только с воздействием на организм ребенка различных антигенов, но с большим влиянием ряда генетических предрасполагающих и экологических факторов. В подавляющем большинстве случаев астма у детей атопическая. Преимущественное значение в развитии БA придается аллергенам растительного и животного происхождения, а также некоторым химическим веществам, проникающим в организм через дыхательные пути. К ингалянтам животного происхождения -клещи домашней пыли, перо птиц, шерсть и перхоть домашних животных, волосы и перхоть человека, насекомые (вернее, частицы их тел, а также эманации пчел, тараканов, клещей бабочек и др.), сухой корм для аквариумных рыбок. Меньшее значение в развитии БA имеет пищевая аллергия. Все внешнесредовые факторы риска развития БA разделяют на три большие группы: индукторы, усилители и триггеры. Индукторы (экзогенные специфические факторы) - это чужеродные белки и химические частички с небольшой молекулярной массой, которые могут спровоцировать иммунный ответ. К ним относят ингаляционные аллергены растительного и животного происхождения, ряд пищевых аллергенов, химические вещества. «Усилители»- агенты, которые находятся во внешней среде (вирусы, различные поллютанты (озон, выхлопные газы, табачный дым и др.), эндотоксины. «Усилители» способные усугублять и даже вызывать воспаление в дыхательных путях, однако они не могут вызывать иммунный ответ с преобладанием функции Th-хелперов 2-го типа с последовательной продукцией IgE. Триггеры («провокаторы»)-агенты, вызывающие обострение БA, путем усиления гиперреактивности бронхов на короткий промежуток времени без развития воспаления в стенке бронхов. К триггерам относят гистамин, метахолин, лекарства, пассивное курение, физические и психоэмоциональные нагрузки, изменение метиоситуации, холодный воздух, резкие запахи, экологические воздействия. При определенных условиях, в качестве триггеров, могут действовать индукторы и усилители. Несмотря на неспособность усилителей и триггеров вызывать иммунный ответ, их роль в качестве факторов риска развития BA у лиц с генетической предрасположенностью весьма значительна. Выявление подобных факторов риска оказывает большую помощь в проведении активных профилактических мероприятий, что способствует снижению частоты обострений астмы. Исходя из современного определения БA, основным патогенетическим звеном в развитии заболевания является хронический воспалительный процесс в стенке бронхов, имеющий аллергическое происхождение. Этот воспалительный процесс координируется T-лимфоцитами-хелперами 2-го типа, которые, как известно, секретируют ряд цитокинов, в состав которых входят интерлейкины (IL-4, IL-5), играющих ключевую роль в развитии аллергического воспаления в бронхах и способствующие повышенному синтезу IgE. Аллергический воспалительный процесс в своем развитии проходит три стадии: - первая - иммунологическая, когда под влиянием различных аллергенов образуются антитела или происходит сенсибилизация лимфоцитов. - вторая - патохимическая, во время которой после повторного воздействия аллергенов из тучных клеток высвобождаются медиаторы воспаления: гистамин, серотонин, брадикинин, простагландины, ацетилхолины, лейкотриены и др. - третья - патофизиологическая, которая проявляется клиническими симптомами астмы. Ведущим клиническим синдромом при БA является обструкция дыхательных путей, протекающая в виде: - острой обструкции, обусловленной преимущественно спазмом гладкой мускулатуры - подострой обструкции, что в большей степени связано с отеком слизистой бронхов - хронической обструкции, обусловленной гиперсекрецией вязкой слизи, вызывающей обтурацию терминальных отделов бронхиального дерева. -прогрессирующей обструкции, обусловленной склеротическими изменениями в стенке бронхов в результате их ремоделирования. Знание указанных типов обструкции дыхательных путей очень важно для клинициста как для определения объема терапии, так и для прогноза заболевания. Первые три типа обструкции представляют собой обратимый процесс, когда просвет бронхов может вернуться к нормальному состоянию самостоятельно или под влиянием проводимой терапии. Прогрессирующая обструкция приводит к необратимым процессам в дыхательных путях - фиброзу. Течение отмеченного аллергического воспалительного процесса (аллергической реакции) протекает по немедленному типу. В реакциях немедленного типа главная роль принадлежит реагинам, вступающим во взаимодействие с антигеном. В первую очередь это IgE, который образует комплекс на поверхности мембран тучных клеток слизистой бронхов (или других клеток воспаления). Вследствие реакции антиген-антитело на мембранах тучных клеток высвобождаются медиаторы воспаления. Важно отметить, что признаки воспаления в дыхательных путях у детей обнаруживаются не только в период обострения заболевания, но и во время наступившего клинического благополучия, что подтверждено морфологическими исследованиями биоптатов слизистой бронхов. Это является одним из оснований для проведения длительной противовоспалительной терапии, отсутствие которой рано или поздно приводит к перестройке (ремодулинг) бронхиального дерева и склерозу. По последним сведениям у детей с тяжелым и длительным течением заболевания признаки фиброза обнаруживаются через несколько (через 4 и более) лет. Данные биопсии констатируют в субмукозном слое бронхов гипертрофию желез, вырабатывающих слизь, утолщение мышечных волокон, увеличение диаметра сосудов, а также изменения в базальной мембране эпителия. Указанные изменения приводят к стойкому утолщению бронхиальной стенки и постепенному уменьшению просвета бронхов. На сегодняшний день положительно повлиять на обратную перестройку поврежденной бронхиальной стенки могут только ингаляционные кортикостероиды. Об аллергически-воспалительной основе БA свидетельствует обнаружение в слизистой оболочке дыхательных путей инфильтратов, содержащих эозинофилы, тучные клетки, лимфоциты, эпителиальные клетки. В результате иммунологических процессов, выделяемые из клеток медиаторы, вызывают спазм гладкой мускулатуры, отек слизистой бронхов и гиперсекрецию слизи. Из названных клеток, участвующих в воспалении, особую роль играют эозинофилы, которые рассматриваются как биомаркеры БA, т.е. эозинофильное воспаление является патогномоничным для астмы. Учитывая генетическую детерминированность иммунных (атопических) реакций, необходимым методом диагностики БA является установление наследственной предрасположенности ребенка к атопии. Согласно научным представлениям последних лет в геном человека входят гены, индуцирующие болезнь и гены, контролирующие ответ на терапию. В развитии атопии участвуют около 20 известных на сегодня генов. Характер наследования при БA - полигенный. Изучение родословной пробанда клинико - генеалогическим методом является неотъемлемой частью диагностики заболевания. Клиника бронхиальной астмы. Клиническая картина БA определяется обострением заболевания, т.е. наличием приступа экспираторного удушья и/или спазматического, преимущественно ночного кашля или наступившей ремиссией. В типичных случаях диагностика обострений, особенно у детей старшего возраста, затруднений не вызывает. Обычно экспираторной одышке предшествует так называемый период предвестников, характеризующийся беспокойством ребенка, раздражительностью, нарушением сна, вазомоторными нарушениями носового дыхания, зудом в носу, ринитом, ощущением першения в гортани, чиханием и, наконец, мучительным сухим приступообразным кашлем. Приступообразный непродуктивный кашель сопровождается дыхательным дискомфортом и нарастающими свистящими хрипами, слышимыми на расстоянии (так называемые, дистанционные хрипы). При аускультации легких в этот период на всем их протяжении масса разнообразных сухих хрипов в большем количестве, чем дистанционных. Апогеем обострения БA является выраженная одышка с затрудненным и продолжительным выдохом. Приступ удушья чаще развивается ночью или в утренние часы. Больные в момент приступа ведут себя беспокойно, мечутся в постели, как бы не находя себе место, особенно это касается детей раннего возраста. Старшие дети могут предъявлять жалобы на головную боль, боль в животе вследствие чрезмерного напряжения мышц брюшной стенки. У больных выражено чувство страха, они стараются во время приступа удушья найти наиболее удобное положение тела, которое облегчает выдох. Как правило, это приподнятая грудная клетка, фиксация плечевого пояса, положение сидя, опираясь руками вперед или на колени. При объективном обследовании больного ребенка в момент приступа удушья обнаруживается эмфизематозное вздутие грудной клетки, над которой перкуторно определяется коробочный звук. Параметры, характеризующие относительную сердечную тупость сужены, отмечается низкое стояние нижней границы легких. При выслушивании легких обнаруживается масса не только сухих хрипов, но и влажных. Хрипы выслушиваются с двух сторон. Сухие хрипы больше слышно на выдохе, влажные - как на выдохе, так и на вдохе. Важно заметить, что чем младше ребенок, тем больше у него преобладает количество влажных хрипов. В подобных случаях, подчеркивая особенность течения БA у детей раннего возраста, говорят о «влажной» астме. Температура тела во время приступа удушья, как правило, нормальная. Однако у детей первых лет жизни может отмечаться субфебрилитет без признаков какого-либо инфекционного процесса. Продолжительность бронхиальной обструкции может составлять от 30 минут до нескольких часов, а в отдельных случаях, например, при развитии астматического статуса (statusasthmaticus) она может сохраняться в течение нескольких дней. Под влиянием терапии или, в легких случаях самопроизвольно, наступает облегчение. Больные начинают откашливать прозрачную, густую мокроту, восстанавливается проходимость бронхов, уменьшается одышка и дыхание становится свободным. Имевшийся во время приступа цианоз лица исчезает. Клиническую картину БA целесообразно дополнить некоторыми особенностями ее течения у детей раннего возраста, (первых двух-трех лет жизни), что важно для своевременной постановки диагноза и назначения адекватной терапии. Ретроспективный анализ диагностики БA у детей старшего возраста показал, что более чем в половине случаев первые клинические симптомы, позволяющие утвердительно говорить о заболевании, имели место в раннем возрасте. Пролонгация с постановкой диагноза вела только к утяжелению заболевания ввиду отсутствия соответствующей терапии. Среди особенностей течения и, соответственно, диагностики БA у детей раннего возраста следует учитывать следующее: - постепенное нарастание бронхиальной обструкции в течение нескольких дней (ринит —> кашель —> затрудненное дыхание) - смешанный характер одышки (экспираторная и инспираторная) - преобладание психомоторного возбуждения при приступе - затяжной характер бронхиальной обструкции - затяжной характер обструктивного синдрома, несмотря на лечение - более частое сочетание БA с другими проявлениями атопии - субфебрилитет на третий-четвертый день обострения, связанный с несовершенством терморегуляции - менее выраженный положительный эффект в сравнении со старшими детьми от применения симпатомиметиков и холинолитиков - затяжной послеприступный период «компенсированный» обструкции - быстрое развитие эмфизематозного вздутия грудной клетки и более частая возможность возникновения ателектазов, что обусловлено анатомофизиологическими особенностями органов дыхания у детей первых лет жизни. В силу отмеченных выше особенностей дебюта БA у детей раннего возраста диагноз устанавливают поздно, нередко в состоянии астматического статуса. Астматический статус - это качественно отличающиеся течение БA, которое характеризуется тяжелым, затянувшимся состоянием удушья более 6 часов, отсутствием положительной клинической динамики от применения в2- агонистов. К причинам развития астматического статуса или, как сейчас принято в педиатрии говорить «асфиксического синдрома», кроме поздней диагностики, относятся: интеркуррентная инфекция, передозировка в2-агонистов, медикаментозная аллергия, (прежде всего, на антибиотики), быстрая отмена системных глюкокортикоидов при длительном их применении, пубертатный возраст. Клиническая картина астматического статуса характеризуется крайне тяжелым общим состоянием, спутанностью или отсутствием сознания вследствие гипоксической комы, выраженной дыхательной недостаточностью по обструктивному типу, наличие метаболического ацидоза, развитие «немого легкого», снижением артериального давления, брадикардией. В детском возрасте градация клинического течения астматического статуса на стадии, заимствованные у терапевтов, мало приемлемо в силу трудностей их дифференцирования. Поэтому в практике принято выделять вышеупоминавшийся «асфиксический синдром». В существующее ныне понятие «астма физического напряжения» не укладывается какой-то отдельный клинико-патогенетический вариант БA. Физическую нагрузку у больных астмой с гиперреактивностью бронхов следует рассматривать как один из триггеров, индуцирующих приступ бронхиальной обструкции. Среди различных вариантов БA особое место занимает, так называемая, аспириновая астма, основным признаком которой является связь приступов удушья с непереносимостью нестероидных противовоспалительных средств. Она часто сочетается с поллинозом и синуситами, и получила название «астматической триады». В основе аспириновой астмы лежит нарушение метаболизма арахидоновой кислоты с повышенным образованием лейкотриенов, обладающих выраженным бронхоспастическим эффектом. Критерии диагностики бронхиальной астмы у детей Из клинических критериев следует выделить следующие: - периодичность возникновения симптоматики (спазматического кашля, приступов удушья) - наличие преимущественно ночных или предутренних приступов удушья и спастического кашля - сезонные обострения заболевания, особенно, в период цветения некоторых трав и деревьев - чрезмерные физические нагрузки у детей с выраженной гиперреактивностью бронхиального дерева - семейный атопический и медико-генетический анамнез - рецидивирующий визинг (wheezing), т.е. шумное свистящее дыхание с удлиненным выдохом у детей раннего возраста, повторившееся 3 и более раз Среди результатов дополнительных методов исследований в состав диагностических критериев входят: - эозинофилия в периферической крови - наличие эозинофилов в лаважной жидкости бронхов и в биоптатах из участков воспаления слизистой бронхов - повышение содержания IgE - нарушение функции внешнего дыхания (ФВД) по данным пикфлуометрии - обнаружение при микроскопии мокроты кристаллов Шарко-Лейдена и спиралей Куршмана. Более углубленное обследование с определением уровня специфических антител, медиаторов воспаления, изучением системы интерлейкинов, исследование иммунного статуса и т.п. проводится по показаниям в специализированных научно-исследовательских учреждениях. Следует заметить, что не все перечисленные дополнительные исследования можно провести у детей раннего возраста в силу невозможности выполнения ими определенных тестов. В клинической практике диагноз БA у детей устанавливается преимущественно на основании тщательного изучения клиникоанамнестических данных. Неотъемлемой частью в постановке диагноза БA считается проведение дифференциальной диагностики с рядом заболеваний, в клинической картине которых одним из ведущих синдромов является бронхиальная обструкция. К таковым относятся: обструктивный бронхит, острый бронхиолит, наследственные и врожденные заболевания бронхолегочной системы и др. Классификация бронхиальной астмы. Учеными различных стран под эгидой ВОЗ в 1995 г. разработана «Глобальная стратегия лечения и профилактика бронхиальной астмы» (GINA), пересмотр проведен в 2002 г., и последний - в 2006 г. Для использования в Украине данная документация регламентирована приказом М3 от 27.12.2005 г. за №767. По консенсусу БA рассматривается как «хроническое воспалительное заболевание дыхательных путей, в котором играет роль многие клетки и клеточные элементы. Хроническое воспаление вызывает сопутствующее повышение гиперреактивности дыхательных путей, приводящее к повторяющимся эпизодам свистящих хрипов, одышке, чувству стеснения в груди и кашлю, особенно ночью или ранним утром. Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности бронхиальной обструкцией, которая является обратимой или спонтанно, либо под влиянием лечения». Попытки классифицировать по этиологическому фактору далеко не всегда могут увенчаться успехом, поэтому выделение форм заболевания (атопическая, инфекционно-аллергическая, смешанная) международным консенсусом подвергается сомнению. По течению предусматривается БA интермиттирующая и персистирующая. С практической точки зрения определение степени тяжести заболевания имеет первостепенное значение, так как именно тяжесть течения БA является ключевым моментом диагностики и тактики лечения больного (см. табл. №1). Использование международного консенсуса по трактовке степени тяжести БA исключает вполне предвидимые трудности и субъективизм в постановке диагноза, так как, согласно инструкции, «наличие у больного хотя бы одного из показателей той или иной степени тяжести достаточно для того, чтобы отнести больного к этой категории». В классификации необходимо указывать периоды течения заболевания: обострение или ремиссия. О ремиссии говорят, если контроль над астмой достигнут на протяжении не менее 3-х месяцев. В диагнозе необходимо также указывать возможные осложнения, к которым относят: эмфизема легких, легочное сердце, пневмосклероз, ателектазы легких, спонтанный пневмоторакс и другие. В последнем пересмотре международного консенсуса по астме (GINA 2006 г.) предлагается о степени тяжести БA судить по уровню её контроля (см. табл. №2). Однако представленные в таблице №2 характеристики уровней контроля БА основаны на соглашении экспертов и пока не утверждены для практического применения. Лечение бронхиальной астмы. Основными составляющими терапии больных астмой являются: лечение в период обострения, базисная терапия и сопутствующая. Лечение в период обострения заключается в оказании неотложной помощи во время приступа удушья, восстановление нормальной функции дыхательных путей, предотвращение развития необратимой обструкции и предупреждение, тем самым, летального исхода. Купирование приступа бронхиальной обструкции проводится ингаляционными в2-агонистами короткого действия и, в отдельных случаях, системными глюкокортикоидами, вводимыми парентерально. Из в2-агонистов короткого действия применяются только селективные препараты, практически не обладающие побочными действиями, не блокирующие в2-адренорецепторы даже при длительном их применении, купирующие бронхоспазм независимо от причин его происхождения. К ним относятся: сальбутамол (вентолин, саламол и др.) в максимальной суточной дозе 400 мкг; фенотерол (беротек), тербуталин (бриканил) 1000 мкг/сут. Наиболее эффективным и безопасным из бронходилятаторов является сальбутамол (вентолин). В педиатрической практике для оказания ургентной помощи при БA применяются также холинолитики, используемые для ликвидации холинэргического компонента бронхоконстрикции. Их применение перспективно у детей раннего возраста потому, что холинэргическая иннервация у них более выражена в крупных и средних бронхах, которые и являются шоковой зоной при обострении БA. Представителем холинолитиков является ипратропиума бромид (атровент), который назначают по 1 ингаляции (0,02 мкг) 3 раза в сутки. Значительно усиливается эффект при комбинации холинолитика с симпатомиметиками. Комбинированными препаратами являются: беродуал (ипратропиума бромид + фенотерол) по 1 ингаляции 3 раза в сутки и комбивент (ипратропиума бромид+сальбутамол) по 1 ингаляции 2-Зраза в сутки. Для детей доставка сальбутамола проводится с помощью бебихалера, спейсера, волюматика. Разовая доза сальбутамола (вентолина) для инголяций через спейсер составляет 100-200 мкг, причем для детей до двух лет - 200 мкг, старшим - 100 мкг. Самым лучшим методом доставки вентолина в ургентных случаях является метод с использованием небулайзера. При использовании небулайзера разовая доза вентолина в небулах (пластиковые ампулы по 2,5 мл, содержащие 2,5 мг сальбутамола) для детей до 5 лет - 0,1 мл/кг массы тела, старше 5 лет - по 2,5 мл на одну ингаляцию. В первый час терапии при тяжелом приступе удушья можно провести 3 ингаляции через спейсер или небулайзер в той же дозе через каждые 20 мин. Te же методы доставки можно использовать и для других спазмолитиков (атровент, беротек, беродуал). Системные глюкокортикоиды при обострениях БA применяются в случаях, когда астматический приступ продолжается более 3-х дней, если имеется резистентность к в2- агонистам, или если ребенок в момент развития приступа находился на лечении ингаляционными глюкокортикоидами. Абсолютным показанием к назначению системных глюкокортикоидов является астматический статус. Системные глюкокортикоиды в ургентных случаях предпочтительно вводить парентерально в дозах по преднизолону: детям до 1 года -1-2 мг/кг/сут, в возрасте 1-5 лет - 20мг/сут, старше 5 лет - 30 мг/сут. Базисная терапия является обязательным компонентом реабилитации больного БA, т.к., согласно последним исследованиям, аллергический, воспалительный процесс в бронхах продолжается и в послеприступном периоде, который, в конечном итоге, приводит к ремодулированию бронхиального дерева и развитию фиброза. Основными научно обоснованными принципами базисной терапии считают: проведение длительной противовоспалительной терапии; в зависимости от тяжести заболевания «ступенчатый» подход к лечению, достижение эффективного контроля астмы и улучшение качества жизни ребенка. Основой базисной терапии БА в настоящее время однозначно являются ингаляционные глюкокортикоиды (ИГК). ИГК показаны при всех степенях тяжести персистирующей БА. В педиатрической практике нашли применение следующие ИГК (в скобках их торговое название): флютиказон (фликсотид), беклометазон (бекотид, бекломет), флунизолид (ингакорт), будесонид (бенакорт, пульмикорт) и некоторые др. Ступенчатый подход к терапии определяет режим дозировок ИГК. Так, при интермиттирующей БА необходимости в базисной терапии нет, но если имело место тяжелое обострение, то объем терапии соответствует среднетяжелому течению персистирующей БА. При легкой персистирующей БА дозы фликсотида от 100 до 200 мг/сут.; беклометазона - 100-400 мкг/сут.; будесонида - 100-200 мкг/сут., в зависимости от возраста. При среднетяжелом течении - фликсотида - 200-500 мкг/сут.; беклометазона - 200-800 мкг/сут.; будесонида - 200-400 мкг/ сут, в зависимости от возраста. При тяжелом течение астмы дозы ИГК более высокие. Приведенные дозы соответствуют рекомендованным международным консенсусом. Минимальный курс терапии, необходимый для становления ремиссии, для всех степеней тяжести после достижения контроля БА составляет не менее 3-х месяцев с последующим постепенным (ступенчатым)снижением дозы на 50% при положительной динамике вплоть до полной отмены. В тяжелых случаях возможен переход на поддерживающую терапию (минимальная доза 1 раз в сутки вечером). Названные ИГК в терапевтических дозах имеют низкую системную биодоступность, что не грозит развитием побочных эффектов, присущих другим глюкокортикоидам. В особо тяжелых случаях терапия дополняется назначением пролонгированных в2- агонистов (серевент по 25-50 мкг 2 раза в сутки), метилксантинол или антилейкотриеновых препаратов (детям с 6 лет -аколат по 20 мг 2 раза в сутки, сингулар по 10 мг на ночь). Системные глюкокортикоиды в качестве базисной терапии БА применяются в исключительных случаях (при гормонзависомой БА). В последние годы появились комбинированные формы противовоспалительных препаратов: серетид (фликсотид+серевент), симбикорт (будесонид + формотерол), которые благодаря своей эффективности находят применение в педиатрической практике (пока детям с 4-х лет). Главной целью в лечении больных БА должен быть достигнут полный контроль заболевания. Достичь последнего при любой степени тяжести персистирующей БА позволяет применение серетида, выпускаемого в двух формах доставочных устройств («Эвохалер» и «Дискус») в следующих дозировках: Ранее применяемые для базисной терапии БА нестероидные противовоспалительные препараты, в настоящее время практически не применяются в виду их малой эффективности (речь идет об интале, тайледе). В качестве сопутствующей и симптоматической терапии при БА применяют муколитики, отхаркивающие средства, иглорефлексотерапию, соляные палаты и др. Многие дети, страдающие БА, имеют сопутствующие очаги хронической инфекции: тонзиллит, аденоиды, кариес и др. Без санации хронических очагов инфекции рассчитывать на быстрое и стойкое достижение ремиссии не приходится. Хронические очаги инфекции являются источниками различных экзогенных триггеров: вирусов, бактерий, грибов. Профилактика бронхиальной астмы. Первичная профилактика БА проводится среди детей группы риска, в которую входят дети с отягощенной наследственностью по атопии, с проявлениями аллергии, с повышенным содержанием в крови эозинофилов и Ig Е, с бронхиальной гиперреактивностью, с поствакцинальными реакциями, группа с повторяющимся визингом различной этиологии. Основные правила профилактики БА: предлагают возможно максимальное ограничение контакта с аэроаллергенами окружающей среды, рациональное питание (грудное вскармливание, гипоаллергенная диета), борьбу с курением (активным и пассивным), закаливание и другие методы физического оздоровления, медикаментозная противоаллергическая профилактика у детей с проявлениями аллергии, улучшение социальных и экологических условий быта. Залогом успеха вторичной профилактики БА, т.е. обострений, является адекватная терапевтическая тактика, санация хронических очагов инфекции, а также соблюдение детьми врачебных рекомендаций. | |
|
| |
| Всего комментариев: 0 | |