11:06 Герпесвирусы и мужское бесплодие | |
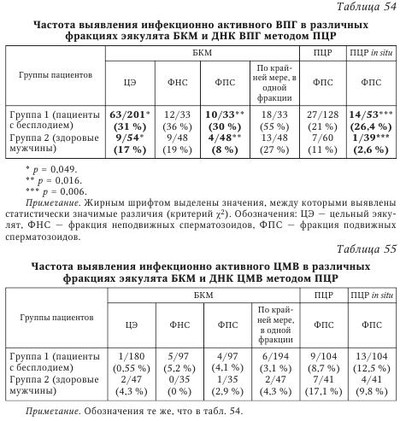
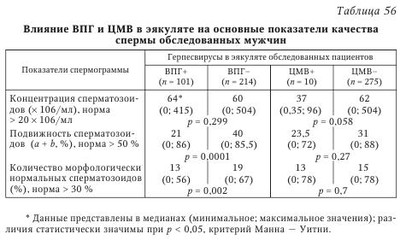
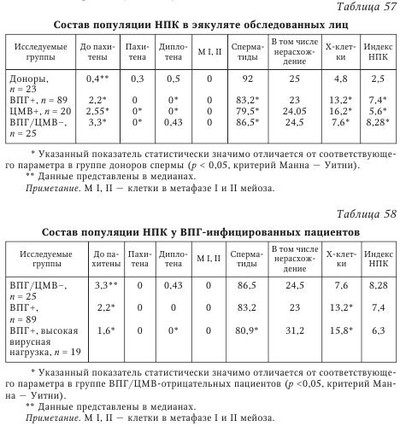
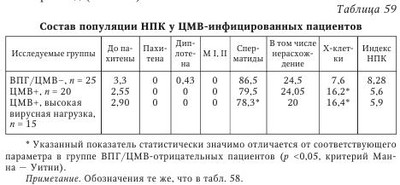
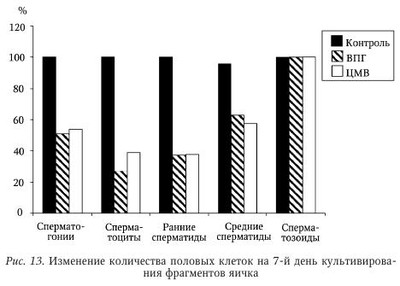
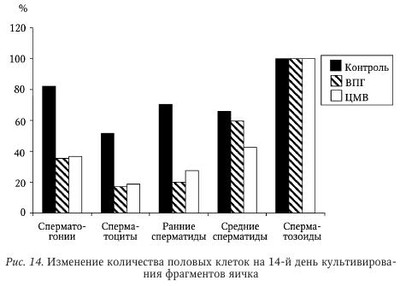
В настоящее время не вызывает сомнения этиологическая роль вируса паротита и ВИЧ в развитии бесплодия у мужчин. Обсуждается также влияние аденовируса, вируса папилломы человека на качество спермы. Несмотря на большое число работ, посвященных роли ГВ в этиологии бесплодия, среди исследователей нет единого мнения по этому вопросу. Частота встречаемости герпесвирусов в эякуляте. Одним из критериев оценки влияния вируса на бесплодие является сравнительный анализ частоты выявления инфекционного агента в эякуляте пациентов с нарушением фертильности и у здоровых мужчин. Данные литературы о частоте выявления ГВ в эякуляте различаются. Использование культурального метода позволяет выявить инфекционно активный ВПГ у 6,7—10,5 % фертильных мужчин и у 25—40 % пациентов с бесплодием. Инфекционно активный ЦМВ выявляется в эякуляте гораздо реже во всех исследуемых группах: у 0,4—2 % серонегативных доноров спермы, у 3,3—4,5 % серопозитивых здоровых мужчин; у 0—2,85 % пациентов с проблемами фертильности. Частота выявления ДНК ВПГ методом ПЦР в эякуляте фертильных мужчин составляет 2,5—47 %, в эякуляте пациентов с бесплодием варьирует от 2,1 до 49,5 %. В исследованиях, выполненных с использованием метода ПЦР, частота обнаружения ДНК ЦМВ в эякуляте здоровых доноров оказалась приблизительно одинаковой: 2,85; 3,5 и 5,1 %. Однако Е. Neufytou выявляли ДНК ЦМВ гораздо чаще — у 62,5 % здоровых мужчин. Частота обнаружения ДНК ЦМВ методом ПЦР в эякуляте пациентов с бесплодием варьирует от 1,4 до 56,5 %. ДНК ВЭБ выявляли в эякуляте 45 % здоровых мужчин и 7,1—39,1 % пациентов с бесплодием. Аналогичные показатели для ВВО-ОГ составили соответственно 1,2 и 0-3,2 %, для ВГЧ-6 - 70 и 4-66,3 %, для ВГЧ-7 - 7 и 0,4—7 %. ВГЧ-8 в эякуляте не обнаружен. Использование РНИФ позволило выявить антигены ВПГ в сперматозоидах 30—51 % здоровых мужчин и 59 % пациентов с проблемами фертильности. Высокая вариабельность частоты выявления ГВ в эякуляте может быть следствием нескольких причин. Одна из них — различия в чувствительности и специфичности используемых методов детекции. Следует отметить, что только культуральный метод позволяет сделать выводы о присутствии полноценного вириона, способного инфицировать чувствительные клетки. Однако этот метод по сравнению с ПЦР обладает меньшей аналитической чувствительностью, особенно при исследовании эякулята, содержащего ингибиторы вирусной активности. С другой стороны, известно выявление ЦМВ в эякуляте на культуре чувствительных клеток при отсутствии детекции вирусной ДНК методом ПЦР. Эффективность выявления ДНК в значительной степени зависит от выбора праймеров и использования различных методик. Так, N. Kapranos методом ПЦР выявляли ДНК ВПГ в эякуляте 3,4 % обследованных лиц и не обнаружили ДНК ЦМВ, однако при использовании гнездовой ПЦР для детекции TB в эякуляте тех же мужчин 49,5 % образцов оказались положительными на ВПГ, 7,1 % — на ЦМВ. Комплексный подход к диагностике ГВИ позволяет уменьшить влияние погрешностей отдельных методов детекции и получить более объективную оценку частоты выявления вирусов в эякуляте. Другая причина различий в частоте встречаемости вирусов в эякуляте связана с особенностями исследуемого контингента. Известно, что ГВ чаще выявляются у пациентов группы риска по ИППП: работников и клиентов сферы сексуальных услуг, мужчин, практикующих секс с мужчинами, ВИЧ-инфицированных, пациентов венерологического профиля. Кроме того, расхождения исследователей в оценке частоты встречаемости ГВ может быть следствием неоднородности распространения ВПГ и ЦМВ в различных регионах земного шара. Так, частота обнаружения ДНК ЦМВ в эякуляте пациентов с бесплодием составляет 2—3 % во Франции; 3,6-8,7 % — в Германии; 7,1—56,5 % — в Греции; 9,6 % — в Китае, 25 % — в США, 33 % — на Тайване. Аналогично частота выявления ДНК ВПГ в эякуляте бесплодных мужчин составляет 3,2-3,7 % в Германии; 4,8 % — в Китае; 2,1—49,5 % — в Греции и 24 % — в Японии. Указанные сложности интерпретации результатов выявления ГВ были учтены в ходе проведения в 2005—2008 гг. в России масштабного исследования маркеров ВПГ и ЦМВ в эякуляте 808 мужчин. Комплексное применение быстрого культурального метода (БКМ), ПЦР и ПЦР in situ позволило выявить ВПГ у 27,2 % обследованных мужчин, ЦМВ — у 8,8 %. Одновременно маркеры ВПГ и ЦМВ были обнаружены в 4,4 % случаев. Сравнительный анализ показал, что ГВ чаще выявляются в эякуляте с декабря по февраль по сравнению с остальными месяцами года: соответственно, 34 % против 24,5 % для ВПГ (р = 0,019) и 15,7 % против 6,8 % для ЦМВ (р = 0,007). Обнаруженные сезонные колебания, возможно, связаны с изменениями температуры окружающей среды и (или) отражают зимнюю иммунодепрессию, вследствие чего происходит реактивация ГВ. Данные о сезонных колебаниях частоты выявления ГВ имеют важное клиническое значение, поскольку дают возможность уменьшить риск горизонтальной и вертикальной передачи ВПГ и ЦМВ при планировании естественной беременности, а также при лечении бесплодия методами вспомогательных репродуктивных технологий (BPT). Из общего числа обследованных мужчин были сформированы две группы: группу 1 (n = 201) составили мужчины, обратившиеся по поводу бесплодия неясной этиологии в браке; группу 2 (n = 54) — здоровые мужчины. Результаты сравнительного анализа частоты выявления ГВ в указанных группах приведены в табл. 54 и табл. 55. Из табл. 54 видно, что инфекционно активный ВПГ выявляли у пациентов с бесплодием чаще, чем у здоровых мужчин, как в цельном эякуляте (31 % против 17 %), так и во фракции подвижных сперматозоидов (30 % против 8 %). Оценка выявляемости ВПГ, по крайней мере, в одной фракции эякулята позволила констатировать высокую суммарную инфицированность эякулята у пациентов с бесплодием (55 %). Частота встречаемости ЦМВ, согласно полученным результатам (см. табл. 55) и данным мировой литературы, не отличается у фертильных и бесплодных мужчин. Можно предположить, что это является результатом низкой частоты встречаемости ЦМВ в эякуляте. He исключено, что отличия будут обнаружены при увеличении выборки обследуемых лиц. Следует отметить, что у всех обследованных мужчин отсутствовали клинические проявления ГВИ, однако BKM выявил у части из них инфекционно активный ВПГ или ЦМВ. Это означает, что выделение вируса происходит при бессимптомной форме ГВИ, которая в таких случаях остается не идентифицированной и представляет опасность как для самого мужчины, так и для полового партнера. Влияние герпесвирусов на показатели спермограммы. Информативный подход к изучению взаимосвязи между инфицированием ГВ и нарушением фертильности состоит в изучении влияния вирусов на показатели качества спермы, определяющие эффективность оплодотворения. В 1998 г. D. Kotronias и соавт. установили корреляцию между инфицированием ВПГ и снижением подвижности мужских гамет. В 2003 г. та же группа авторов сообщила о снижении концентрации сперматозоидов и их подвижности в группе лиц, выделяющих ДНК ВПГ с эякулятом. Концентрация сперматозоидов в пробах, содержащих ДНК вируса, составила 20 млн/мл, в неинфицированных образцах — 55 млн/мл; процент подвижных форм — 39 и 49 % соответственно. G. Bezold и соавт. отмечали значительное снижение концентрации сперматозоидов (34 млн/мл против 77 млн/мл) и их подвижности (39 против 58 %) у мужчин с ВПГ в эякуляте по сравнению с неинфицированными лицами. К. Н. Wu и соавт. также свидетельствуют о значительном снижении концентрации сперматозоидов в образцах, содержащих ВПГ, по сравнению с неинфицированными пробами. При обследовании пациентов, обратившихся по поводу бесплодия в браке, А. Г. Абдулмеджидова и соавт. не выявили отличий по основным показателям спермограммы у ВПГ-инфицированных пациентов по сравнению с группой контроля. Однако при детальном изучении морфологии было показано, что такие дефекты, как микроголовки и сохранение цитоплазматической капли на шейке, коррелировали с обнаружением ВПГ в эякуляте. В то же время данные других исследователей свидетельствуют об отсутствии влияния ВПГ на качество спермы. Е. Н. Бочарова и соавт. по результатам обследования 29 пациентов с вирусным инфицированием эякулята не выявили влияния ВПГ на показатели спермограммы. В двух масштабных исследованиях последних лет, охватывающих широкий спектр ГВ, не было выявлено значимого влияния ВПГ на показатели качества спермы. О негативном воздействии ЦМВ на показатели качества спермы свидетельствуют единичные работы. D. J. Lang и соавт. в серии экспериментов показали, что у пациентов с мононуклеозоподобным синдромом ЦМВ-этиологии высокая концентрация вируса в эякуляте коррелировала с транзиторным снижением подвижности сперматозоидов. К. Н. Wu и соавт. (2007) указывают на уменьшение концентрации сперматозоидов у пациентов, выделяющих ЦМВ с эякулятом. Однако большинство исследователей сходятся во мнении об отсутствии влияния ЦМВ на показатели спермограммы. При анализе данных литературы выяснилось, что среди исследователей, свидетельствующих о негативном влиянии ГВ на сперматогенез, нет единства в определении характера этого влияния. В одних работах имеются указания на снижение концентрации сперматозоидов, в других — на снижение их подвижности, в третьих — на нарушение морфологии. Возможно, различия в оценке влияния вируса на качество спермы связаны с высокой вариабельностью показателей спермограммы. Учитывая значительный разброс исследуемых признаков, можно предположить, что установить их отклонение под воздействием какого-либо фактора возможно только при большом объеме выборки. Данные, полученные нами при изучении 315 спермограмм мужчин, инфицированных и не инфицированных ГВ, представлены в табл. 56. Полученные результаты свидетельствуют о негативном влиянии ВПГ на подвижность сперматозоидов и количество морфологически нормальных гамет в эякуляте. При наличии инфекционно активного ЦМВ в эякуляте концентрация сперматозоидов оказалась в 1,7 раза ниже, чем при его отсутствии, однако статистический анализ различий (р = 0,058) позволяет судить лишь о тенденции к снижению данного показателя. Влияния ЦМВ на подвижность и морфологию сперматозоидов в эякуляте выявлено не было. О влиянии других ГВ на показатели спермограммы известно немного. В двух исследованиях, охватывающих ГВ 1—6 типов, не выявлено воздействия вирусов на качество спермы. Влияние герпесвирусов на состав популяции незрелых половых клеток (НПК) в эякуляте. До 1980-х гг. для изучения сперматогенеза проводили исследование гистологических срезов или отпечатков, приготовленных из биопсийного материала яичек. Однако было показано, что данная процедура может привести к развитию аутоиммунных процессов. Метод количественного кариологического исследования НПК в эякуляте, разработанный Л. Ф. Курило, позволяет оценить процессы, происходящие в семенных канальцах, без инвазивного вмешательства. С использованием данного метода было обследовано 128 пациентов с нарушениями фертильности и 23 донора спермы. Разделение пациентов на группы проводили в соответствии с результатами выявления вирусных маркеров (ДНК и (или) вирусной активности) в эякуляте: ВПГ-положительные (n = 89), ЦМВ-положительные (n = 20) пациенты, а также мужчины с нарушениями фертильности, у которых ВПГ/ЦМВ в эякуляте не были выявлены (n = 25). Было показано, что у пациентов с нарушениями фертильности вне зависимости от присутствия ГВ значительно изменен состав популяции НПК по сравнению с донорами спермы (табл. 57). Сходные данные были получены другими исследователями. Для выявления изменений в созревании половых клеток, характерных для ВПГ-инфекции, проведено сравнение образцов в группах инфицированных и неинфицированных пациентов с бесплодием. Сравнительный анализ показал увеличение числа дегенеративных половых клеток (Х-клеток) у мужчин, в эякуляте которых обнаружен ВПГ. В группе пациентов с высокой вирусной нагрузкой дополнительно к указанным изменениям выявлено снижение числа сперматоцитов I порядка на стадии диплотены и сперматид по сравнению с контролем (табл. 58). Количество сперматоцитов I на предпахитенных стадиях в эякуляте ВПГ-инфицированных бесплодных мужчин оказалось выше по сравнению с донорами спермы, но ниже, чем у пациентов с бесплодием, в эякуляте которых вирус не обнаружен. Более выраженный предпахитенный блок у неинфицированных мужчин не позволяет считать это нарушение характерной особенностью ГВИ. При сравнении популяции НПК у бесплодных мужчин, инфицированных и не инфицированных ЦМВ, обнаружено повышение количества Х-клеток в присутствии ЦМВ. У пациентов с высоким содержанием ЦМВ в эякуляте дополнительно выявлено снижение числа сперматид (табл. 59). Снижение количества сперматид у пациентов с ГВИ позволяет предположить, что под влиянием вируса происходит гибель или замедление развития на этапе спермиогенеза. Нельзя также исключить влияния ГВ на предшествующие стадии развития половых клеток — у пациентов с высокой вирусной нагрузкой по ВПГ показано снижение числа сперматоцитов I на стадии диплотены. Значительное увеличение количества неидентифицируемых клеток в эякуляте бесплодных мужчин с ГВИ отражает дегенеративные процессы в популяции половых клеток. Полученные результаты согласуются с данными К. Н. Wu и соавт., которые описывают в эякуляте, инфицированном ВПГ и ЦМВ, увеличение числа НПК с признаками дегенерации: пикнотичными ядрами, вакуолизацией хроматина, нарушениями целостности ядерной оболочки, наличием телец апоптоза. Изучение влияния герпесвирусов на сперматогенез на экспериментальных моделях. Для изучения роли различных факторов, влияющих на сперматогенез, широко используются экспериментальные модели: клеточные и органные культуры; лабораторные, в том числе трансгенные, животные. При культивировании ВПГ со сперматозоидами in vitro не было выявлено влияния вируса на качество спермы при рутинном подсчете спермограммы. Однако использование компьютерной методики подсчета клеток позволило выявить снижение количества подвижных сперматозоидов при культивировании с ВПГ по сравнению с контрольной группой (57,2 против 64 %). Кроме того, в присутствии вируса было показано увеличение значений таких специальных показателей, как скорость циркулярного движения, средняя амплитуда латерального отклонения головки, линейное ускорение, а также снижение процента линейности. Воздействия ЦМВ на сперматозоиды в аналогичном эксперименте не выявлено. Эксперименты на химерных животных позволили исследователям раскрыть некоторые молекулярные механизмы влияния ВПГ на сперматогенез. У трансгенных мышей со встроенным геном тимидинкиназы ВПГ-1 (HSV-1-tk) были выявлены нарушения фертильности у самцов. При этом показано, что в семенниках на фоне повышенной экспрессии HSV-1-й происходит нарушение процесса созревания мужских половых клеток, появляются акросомные аберрации, а также структурные аномалии шейки и жгутика сперматозоида. В одном из исследований экспрессию HSV-1-tk наблюдали сразу после завершения мейоза на ранних стадиях спермиогенеза, а накопление тимидинкиназы — в круглых сперматидах. В 2009 г. было показано, что тимидинкиназа ВПГ-1 вызывает апоптоз клеток сперматогенеза, находящихся на различных стадиях дифференцировки: сперматогониев, сперматоцитов, сперматид. При этом с возрастом отмечали постепенную гибель сперматогенного эпителия. У 3-месячных трансгенных мышей при сохранности сперматогониев и сперматоцитов наблюдали резкое снижение числа сперматид и присутствие большого числа дегенерирующих половых клеток и аномальных сперматозоидов; у 6-месячных мышей были выявлены значительные дегенеративные изменения клеток всех стадий сперматогенеза, а у 12-месячных мышей — тотальная гибель половых клеток. Однако иммуногистохимический анализ позволил выявить тимидинкиназу ВПГ-1 только в круглых сперматидах, но не в других клетках семенника, что позволило авторам сделать вывод, что нарушения сперматогенеза, вызванные эктопической экспрессией HSV-l-tk, происходят на этапе круглых сперматид. Предположительно, вследствие ферментативной активности тимидинкиназы, накапливающейся в цитоплазме сперматид, происходит истощение запасов АТФ, необходимых для дальнейшего созревания половых клеток, что и лежит в основе нарушения фертильности у трансгенных мышей. Видоспецифичность ЦМВ является серьезным препятствием на пути изучения влияния вируса на сперматогенез, поскольку не позволяет моделировать процессы, происходящие в организме человека, на лабораторных животных. В 2010 г. удалось разработать модель герпетической и ЦМВ-инфекции in vitro на органной культуре яичка человека из операционного материала, полученного от пациентов с раком предстательной железы после выполнения радикальной простатэктомии с орхэктомией. Зараженные и интактные фрагменты яичка культивировали in vitro и изучали морфологию культуры в динамике. Для количественной оценки морфологических изменений рассчитывали индекс сперматогенеза (ИС) — показатель, характеризующий численность и структуру популяции половых клеток. Снижение ИС в незараженной органной культуре в течение 16 дней составило менее 4 % (с 3,32 до 3,19). Ультраструктурный анализ показал, что архитектоника органа и морфология половых клеток позволяют изучать in vitro процессы, происходящие в яичке, в течение, по крайней мере, двух недель. Сравнение ИС в зараженной и интактной культуре позволило выявить гаметотоксический эффект ВПГ: на 16-й день ИС составил 2,67 против 3,19 (р < 0,05). Морфологические изменения, вызванные ЦМВ, оказались менее выраженными: на 16-й день инфекции ИС в зараженной и интактной культуре составил соответственно 2,99 и 3,19 (р < 0,05). Для выявления стадий развития половых клеток, подверженных вирусному воздействию, рассчитывали количество жизнеспособных сперматогониев, сперматоцитов, ранних и средних сперматид, а также сперматозоидов в динамике инфекции относительно исходной популяции половых клеток. Результаты количественного анализа половых клеток в зараженной ГВ и контрольной культуре на 7-й и 14-й дни культивирования представлены на рис. 13 и рис. 14. Как видно из рис. 13, на 7-й день культивирования выявлено снижение численности популяции сперматогониев, сперматоцитов, ранних и средних сперматид (р < 0,05) во фрагментах яичка, зараженных как ВПГ, так и ЦМВ, по сравнению с интактной культурой. На 14-й день культивирования in vitro наблюдали снижение численности популяции половых клеток в контрольных и зараженных образцах, что связано с воздействием условий культивирования (см. рис. 14). Снижение численности сперматогониев, сперматоцитов и сперматид на 14-й день в культуре были более выраженными (р < 0,05) во фрагментах органа, инфицированных ГВ, по сравнению с контролем. Полученные данные позволяют сделать вывод, что при ГВИ яичка происходит гибель клеток-предшественников сперматозоидов — сперматогониев, сперматоцитов, сперматид. При этом наиболее чувствительными оказываются клетки, находящиеся в мейозе — спер-матоциты — и образующиеся в результате мейотического деления ранних стадий спермиогенеза — ранние сперматиды. Представленные результаты согласуются с данными количественного кариологического исследования, при котором выявляли снижение в эякуляте сперматоцитов и сперматид в присутствии ГВ (см. табл. 45, 46). Обращает на себя внимание 100 %-я сохранность сперматозоидов в инфицированной культуре. По всей видимости, патологические изменения, приводящие к нарушению фертильности у мужчин, происходят в яичке до формирования зрелых половых клеток. Таким образом, в совокупности данные о высокой частоте выявления ВПГ в эякуляте мужчин с бесплодием, ухудшении показателей качества спермы, изменении состава популяции НПК у ВПГ-инфицированных лиц, а также о гаметотоксическом воздействии вируса в экспериментальных модельных системах указывают на то, что ВПГ играет определенную патогенетическую роль в формировании мужского бесплодия. Вопрос об этиологической роли ЦМВ в развитии бесплодия у мужчин остается спорным. С одной стороны, описаны нарушения в составе популяции половых клеток как методом количественного кариологического анализа в эякуляте ЦМВ-инфированных мужчин, так и на модели ЦМВ-инфекции яичка in vitro. С другой стороны, большинство исследователей указывают на отсутствие воздействия вируса на основные показатели спермограм-мы. Учитывая относительно низкую частоту выявления ЦМВ в эякуляте, необходимо проведение более масштабных исследований для установления роли ЦМВ в развитии бесплодия у мужчин. О роли ГВ в развитии нарушений фертильности у мужчин косвенно свидетельствуют также данные об эффективности терапии ех juvantibus. Сообщалось о наступлении беременности у трех ранее бесплодных пар после прохождения партнером курса противовирусной терапии. Другие авторы описывают эффективность лечения ацикловиром у 5 из 12 бесплодных пар. Установление связи между герпесвирусным инфицированием эякулята и бесплодием у мужчин указывает на необходимость включения исследования на маркеры ГВ (ПЦР, БКМ) в алгоритм диагностики мужского бесплодия. Этиологическая расшифровка диагноза открывает перспективы использования специфической противовирусной терапии в лечении данных пациентов. | |
|
| |
| Всего комментариев: 0 | |