13:14 Классификация клинических форм герпесвирусных инфекций у лиц со сниженным иммунитетом | |
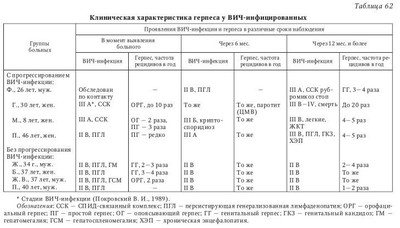
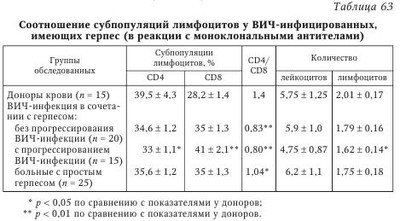
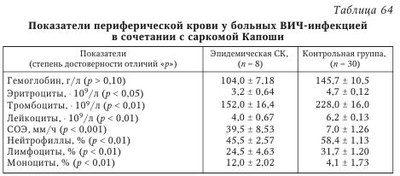
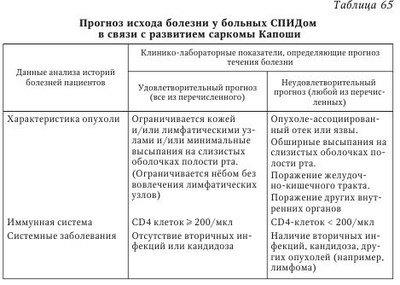
I. Простой герпес. Атипичные формы; — зостериформный простой герпес (ПГ); — герпетиформная (герпетическая) экзема Капоши; — язвенно-некротическая форма. Генерализованные формы: — висцеральная (менингит, энцефалит, гепатит и др.); — диссеминированная (встречается только у лиц с тяжелой иммуносупрессией и у детей до 1 мес., относится к СПИД-индикаторным болезням. Течение ее укладывается в клинику вирусного сепсиса — поражение многих органов и систем сопровождается лихорадкой, интоксикацией, ДВС-синдромом. Летальность около 80 %). II. Ветряная оспа — опоясывающий герпес. Гангренозная форма. Геморрагическая форма. Тяжелые осложнения (пневмония, энцефалит, миокардит, гепатит). Язвенно-некротическая форма. Генерализованная форма: — висцеральная (менингит, энцефалит, реже — гепатит, пневмония и др.); — диссеминированная форма (встречается редко, у лиц с иммуносупрессией (CD4+ менее 200 кл/мкл)). III. Инфекция, вызванная вирусами Эпстайна — Барр. Септическая форма инфекционного мононуклеоза. Лимфома Беркитта - новообразование челюсти. Лейкоплакии слизистых оболочек языка, полости рта, реже половых органов. Назофарингеальная карцинома. IV. Цитомегаловирусная инфекция. Генерализованная форма инфекции: — гепатит (подострый и хронический); — колит; — пневмония (в сочетании с бактериальными осложнениями); — энцефалит; — хориоретинит. (Поражение селезенки и лимфатических узлов.) V. Инфекция, вызванная вирусами герпеса человека 6-го и 7-го типов. Генерализованные формы инфекции: — энцефалиты; — пневмонии; — лимфаденопатии. (Как следствие реактивации вирусов герпеса у больных с ИДС — лейкемия, после трансплантации органов, СПИД, коллагенозы и др.) VI. Инфекция, вызванная вирусом герпеса человека 8-го типа. Саркома Капоши у ВИЧ-серонегативных людей. Саркома Капоши, ассоциированная с ВИЧ-инфекцией и СПИДом. Лимфопролиферативные заболевания: — лимфома первичного экссудата; — многоочаговое заболевание Кастлемана. Следует отметить, что внезапное увеличение частоты рецидивов, распространение и миграция очагов поражения иногда возникают раньше, чем клинические симптомы развивающейся злокачественной опухоли любой локализации. Таких пациентов необходимо тщательно обследовать (в том числе на СПИД), особенно если нет других причин для развития иммунодефицита. Показано, что основная роль в формировании противогерпетического иммунитета принадлежит клеточным механизмам, состояние которых во многом определяет исход первичного инфицирования, частоту и напряженность рецидивов заболевания. Длительность иммунодефицита при вирусных инфекциях во многом определяется как свойствами самого вируса, так и типом ответных реакций больного. Нередко у ВИЧ-инфицированных ВПГ-1 и ВПГ-2 вызывают кожно-слизистые поражения, которые имеют часто рецидивирующий, распространенный характер, длительно не заживают (более 1 мес.). При ГГ, наряду с поражением перианальной области с болью и зудом, процесс может захватывать дистальную часть прямой кишки, что сопровождается болями при дефекации, выделениями и запорами. Могут быть лихорадка, увеличение паховых лимфатических узлов и симптомы крестцовой нейропатии. Стадия СПИДа характеризуется язвенно-некротическими поражениями, когда на месте везикул образуются язвы диаметром 2 см и более. Язвы могут быть глубокими с неровными краями. Эти кожные поражения сохраняются в течение нескольких месяцев, а обратное развитие с отторжением корок и эпителизацией язв, процессом рубцевания происходит очень медленно. Такие поражения часто встречаются у пациентов с количеством CD4+ менее 100 кл/мкл и также часто ассоциируются с ацикловиррезистентными штаммами ВПГ. По классификации ВОЗ простой герпес относится к СПИД-индикаторным (оппортунистическим) заболеваниям 1-й группы, когда диагноз СПИДа может быть поставлен без лабораторного подтверждения. Тяжело протекает генерализованный простой герпес (ПГ). Выделяют висцеральную и диссеминированную формы генерализованного ПГ. Висцеральная форма характеризуется поражением одного органа или системы, когда возникает серозный менингит, гепатит, пневмония и т. п. Возможно проникновение ВПГ в мозг гематогенным или ретроаксональным (из ганглиев нервов) путями. He исключено первичное размножение вирусов в ганглиях с последующим распространением в мозг. Считают, что диссеминированная форма ПГ встречается только у лиц с тяжелым ИДС и у детей до 1 мес. и относится к СПИД-индикаторным болезням. Течение ГВИ укладывается в клинику вирусного сепсиса, когда поражение органов и систем сопровождается лихорадкой, интоксикацией, геморрагической сыпью и кровотечениями. Отмечаются тяжелый гепатит, диффузный менингоэнцефалит, бронхопневмония, синдром ДВС. Во всех пораженных органах — обширные некрозы, геморрагические поражения. Летальность составляет 80 %. Прогрессирующие при ВИЧ-инфекции иммунологические нарушения сопровождаются увеличением числа выявляемых методом молекулярной гибридизации герпесвирусов (табл. 61). При этом прогностически наиболее значимым является одномоментное определение ДНК ВПГ-1, ЦМВ и ВГЧ-6 у больных ВИЧ-инфекцией. В этом случае ГВИ характеризовались непрерывно рецидивирующим течением и более тяжелой клиникой ВИЧ-инфекции с неблагоприятным исходом. Под наблюдением находились ВИЧ-инфицированные взрослые и дети: кожно-слизистая форма рецидивирующего ПГ отмечалась у 24 из 56 взрослых и у 18 из 46 детей. Длительное наблюдение ВИЧ-инфицированных показало, что при прогрессировании ВИЧ-инфекции (переход болезни в следующую стадию) отмечаются более частые рецидивы ГВИ, обусловленные различными серотипами вируса (табл. 62). При наблюдении больная Г., 30 лет, имела III А стадию ВИЧ-инфекции — СПИД-связанный комплекс (CCK), рецидивы ПГ до 10 раз в год. Через полгода выявлены сиалоаденит цитомегаловирусной этиологии, распространенная форма ПГ (орофациальный и генитальный — ВПГ-1 и ВПГ-2). Через год отмечалось прогрессирование ВИЧ-инфекции в IV стадию (СПИД), имеющее крайне тяжелое течение и приведшее к смерти больной. Частота рецидивов ПГ была до 20 раз в год, т. е. практически это непрерывно рецидивирующая форма ГВИ. Отмечалось образование длительно не заживающих, глубоких, болезненных эрозий и язв с неровными краями. Клиническое ухудшение сопровождалось негативной иммунологической динамикой: резкое снижение CD3, CD4 Т-лимфоцитов, натуральных киллеров, снижение их функциональной активности (табл. 63). Таким образом, ГВИ у ВИЧ-инфицированных и больных СПИДом часто имеют тяжелое и длительное клиническое течение с генерализацией инфекционного процесса, развитием осложнений и онкопатологии. При этом нередко больной инфицирован одновременно ГB нескольких типов, в результате чего ГВИ может приобретать непрерывно рецидивирующий характер и в конечном итоге способствует прогрессированию клиники с активной репликацией ВИЧ. Считают, что у женщин рецидивирующий герпес, вызванный ВПГ-2, может привести к возникновению карциномы шейки матки. На фоне ВИЧ-инфекции возможно развитее крайне редкой формы ПГ — герпетигеского фолликулита, который бывает исключительно у мужчин в зоне роста бороды и усов, реже — в области груди и шеи. Врожденная инфекция, обусловленная ВПГ, как и приобретенная ГИ, может протекать в локализованной, распространенной и генерализованной формах. При диссеминированной инфекции поражаются жизненно важные органы с развитием энцефалита, гепатита, пневмонита, с поражением кожи и слизистых оболочек (либо без их поражения). Отсутствие терапии приводит к летальности до 65 %. Опоясывающий герпес у ВИЧ-инфицированных пациентов. Н. В. Сизова с соавт. (2003) наблюдали 16 ВИЧ-инфицированных пациентов с диагнозом ОГ, в том числе 8 мужчин и 8 женщин в возрасте от 19 до 50 лет. Из них 6 человек инфицировалось при внутривенном введении наркотиков, 10 — при половых контактах. Два пациента имели сопутствующий ХГС, а 7 пациентов — ХГС и гепатит В. У 4 пациентов ВИЧ-инфекция впервые выявлена в связи с госпитализацией в инфекционную больницу по поводу ОГ. Остальные пациенты уже наблюдались с диагнозом ВИЧ-инфекции, а 6 из них получали антиретровирусную терапию (APBT). У 5 больных срок инфицирования был неизвестен, у остальных сроки инфицирования ВИЧ были от 1 года до 14 лет. По стадиям ВИЧ-инфекции (классификация CDC, 1993) больные распределялись следующим образом: А-2 — 1 человек, В-2 — 10 человек, В-3 — 3 человека, С-3 — 2 человека. В 81,2 % случаев заболевание протекало в легкой и среднетяжелой форме. Тяжелое течение было у 3 больных, заболевание осложнилось серозным менингитом. В 2 случаях сыпь локализовалась на лице, в 14 — на коже грудной клетки. У всех пациентов наблюдался болевой синдром, у 3 пациентов развилась стойкая ПЗН. В клиническом анализе крови общее число лейкоцитов колебалось от 2,5 до 9,0 • 109/л (лимфоцитов 30,8 ± 2,9 %). Абсолютное количество CD4 T-лимфоцитов было от 89 до 614 кл/мкл (в среднем 296 ± 37 кл/мкл), относительное содержание CD4 Т-лимфоцитов 13—28 % (в среднем 20,4 ± 1,2 %). Особый интерес представляет группа пациентов, получавших АРВТ. В этих случаях реактивация ВВЗ произошла у ВИЧ-инфицированных на фоне APBT с положительным эффектом в течение более 4 мес. От общего числа пациентов (72 человека), получающих АРВТ, это составило 6 человек (8,3 %), что соответствует литературным данным (Domingo Р., 2001). Вероятно, здесь имела место парадоксальная реакция, или так называемый воспалительный синдром восстановления иммунной системы (ВСВИС) (immune reconstitution inflammatory syndrome, IRIS) на начало антиретровирусной терапии, когда может ухудшиться общее состояние пациента и/или обостриться течение оппортунистической инфекции. Считается, что ВСВИС развивается после начала APBT у больных ВИЧ-инфекцией с выраженным иммунодефицитом, высокой вирусной нагрузкой и с существующей оппортунистической инфекцией. Предположительным механизмом возникновения ВСВИС является количественное и качественное восстановление патоген-специфического клеточного и гуморального иммунного ответа против различных возбудителей. Предполагается, что вторичные заболевания при глубокой иммуносупрессии протекают латентно, а при восстановлении клеточного иммунитета — «размаскировываются» проявлением яркой клинической картины. Такая реакция обычно развивается в первые 1—3 мес. после начала APBT. Для пациентов с реактивацией ВВЗ на фоне APBT характерно относительно быстрое увеличение CD4 Т-лимфоцитов во время первых недель APBT и большая пропорция CD8 Т-лимфоцитов. В группе пациентов, получающих АРВТ, срок инфицирования колебался от 3 до 14 лет (в среднем 8,8 ± 2,1 года). Пациенты данной группы получали APBT от 4 до 10 мес., у всех высыпания локализовались на коже грудной клетки, болевой синдром был слабо выражен и практически отсутствовал синдром общей интоксикации. Среднее значение CD4 Т-лимфоцитов в этой группе составило 267 ± 90 кл/мкл (19 ± 2,2 %). В группе пациентов, не получавших АРВТ, число СБ4-клеток было 310 ± 37 кл/мкл (20,9 ± 1,5 %). Случай из практики сочетанного поражения герпесвирусами (ЦМВ и ВПГ) ВИЧ-инфицированного пациента. Больной П., 39 лет. Диагноз: ВИЧ-инфекция, стадия B2/III Б. Распространенный микоз кожи. Хронический персистирующий гепатит В. Цитомегаловирусная инфекция, латентная форма. Диарейный синдром. Инфицирован в 1988 г., половой путь заражения. За период 1991—1994 гг. наблюдалось резкое прогрессирование ВИЧ-инфекции, пациент неоднократно был госпитализирован в городскую инфекционную больницу им. С. В. Боткина. Злоупотребляет алкоголем, инвалид I группы. При первичном обследовании в 1989 г. был выявлен только синдром ПГЛ. С 1990 г. (приблизительно через 1—1,5 года после инфицирования) больной стал отмечать быструю утомляемость, слабость, появились грибковые поражения стоп и себорейный дерматит. С 1991 г. появились раздражительность, эмоциональная лабильность, диарейный синдром (в 1991—1993 гг. эпизоды диареи отмечались почти ежемесячно), ухудшился сон, стало прогрессировать похудание. В 1992 г. при компьютерной томографии (KT) головного мозга установлена атрофия лобных долей головного мозга. С августа 1992 г. появилась головная боль, в январе 1993 г. госпитализирован в больницу. С момента поступления отмечались лихорадка, нарастающая головная боль, появились менингеальные симптомы. После люмбальной пункции диагностирован менингит, вызванный грибом рода Rhodotorulla spp. Наряду с грибковым менингитом констатирован себорейный дерматит волосистой части головы, ушных раковин, лица, микоз гладкой кожи туловища, онихомикоз кистей и стоп, руброфития стоп, герпетический стоматит, мелкоочаговая пневмония. Положительная реакция Вассермана (++++). Получал терапию: азидотимидин (600 мг/сут), микоцитин, низорал, ацикловир (1000 мг/сут), бисептол, больному неоднократно переливалась донорская кровь и вводился иммуноглобулин. Повторная госпитализация в стационар с 04.10.1993 г. по 11.03.1994 г. За неделю до госпитализации отмечено ухудшение: повышение температуры до субфебрильных значений, нарастание головной боли, появился кашель. Клинико-лабораторное обследование позволило исключить пневмонию, диагностировать повторно менингит, вызванный грибом рода Rhodotorulla spp. Выздоровление от 09.02.1994 г. после контрольной люмбальной пункции и микологического культурального обследования. Наряду с менингитом имелась выраженная гипохромная анемия, лейко- и тромбоцитопения, обострение простого герпеса генитальной и перианальной локализации, рецидивирующий себорейный дерматит. Выявлена отчетливая тенденция к снижению числа субпопуляций Т-лимфоцитов в динамике: CD3+ (822 - 573 - 420 -637), CD4+ (305 - 213 - 155 - 235), CD8+ (517 — 360 — 265 — 402). Коэффициент CD4+/CD8+ оставался равным 0,59. Проводилось лечение: азидотимидин (600 мг/сут), низорал, затем споранокс по поводу микотического менингита (по 2 капсулы 4 раза в сутки до выписки): неоднократные переливания крови; ацикловир (1000 мг/сут в течение 5 дней), антибиотики (ампиокс, гентамицин), бисептол (по 1 таблетке 2 раза в неделю постоянно): травокорт и травоген (мази) для лечения себореи; витамины, другие симптоматические средства. Выписан в удовлетворительном состоянии с диагнозом: ВИЧ-инфекция, стадия СПИДа. Гипохромная анемия, лейкопения, тромбоцитопения. Микотическая инфекция, вызванная грибами рода Rhodotorulla spp. Рецидив микотического менингита. Локализованная герпетическая инфекция (генитальный и перианальный герпес). Цитомегаловирусная инфекция, латентная форма. Реконвалесцент по сифилису. Ангиопатия сетчатки обоих глаз. Стеатоз печени (больной скончался в конце 1995 г.). Необходимо отметить возможность рецидивирующего течения ОГ у 10—15 % лиц со сниженным иммунным статусом и у ВИЧ-инфицированных любого возраста, в том числе молодых людей. При этом 20—30 % ВИЧ-инфицированных имеют один и более эпизодов ОГ с поражением нескольких дерматомов и развитием распространенной формы болезни. Более чем у 10 % ВИЧ-инфицированных отмечаются рецидивы ОГ в течение года, а у 15 % больных развивается синдром ПЗН. Синдром ПЗН является тяжелым осложнением ОГ, характеризуется сильными болями по ходу пораженных дерматомов. К сожалению, боли плохо купируются и могут сохраняться месяцы и годы. Клиника ОГ у ВИЧ-инфицированных нередко сопровождается поражением ЦНС: мультифокальные лейкоэнцефалиты, вентрикулиты, миелиты и миелорадикулиты, невриты зрительного нерва, асептические менингиты. У больных со сниженным иммунным статусом возможно осложнение в виде острого некроза сетчатки, а у ВИЧ-инфицированных при CD4+ менее 100 кл/мкл — еще и прогрессирующий некроз сетчатки (возможна отслойка сетчатки). Оба осложнения часто заканчиваются слепотой. Диссеминированная форма ОГ развивается у 10 % больных с признаками вторичной иммунологической недостаточности различного генеза: ВИЧ-инфекция, онкологическая патология, заболевания крови, пересадка органов и тканей. На фоне латентной ВЭБ-инфекции возможно инфицирование ВИЧ, что бывает нередко. ВИЧ-инфекция приводит к активизации мононуклеозной инфекции. При этом чаще выделяется ВЭБ методом ПЦР из материалов, взятых из носоглотки, изменяются титры антител к различным компонентам вируса. У ВИЧ-инфицированных возможно возникновение лимфом, обусловленных ВЭБ. Однако генерализованных инфекций с поражением ЦНС и внутренних органов при мононуклеозе обычно не наблюдается (Казанцев А. П., 2003). В регионах России, где эпидемия ВИЧ-инфекции началась 20—22 года назад (Москва, Санкт-Петербург, Волгоградская область), ВИЧ/СПИД характеризуется рядом особенностей распространения и клинико-лабораторных проявлений. Наблюдается увеличение количества больных в прогрессирующих стадиях ВИЧ-инфекции, в связи с тем что пациенты, находящиеся в стадии 4А, 4Б, перешли в стадию 4В с развитием оппортунистических заболеваний. Интересные результаты были получены при изучении клинико-лабораторных особенностей ГИ и хронического гепатита С у больных ВИЧ/СПИД в Волгоградской области. Была изучена клиническая картина у 688 пациентов, морфологические исследования проведены у 70 умерших. Иммунный статус был изучен у 374 больных. Группы обследованных лиц: больные ВИЧ-инфекцией — 239 чел., в том числе в сочетании с ПГ — 99 чел., в сочетании с ОГ — 40 чел., в сочетании с CK — 8 чел., в сочетании с ХГС — 114 чел., больные ПГ — 76 чел., больные ХГС — 112 чел. Простой герпес занимает 2-е место в структуре вторичных инфекций; в динамике инфекционного процесса у больных ВИЧ-инфекцией острые формы ГИ по мере прогрессирования иммунодефицита встречаются все реже, уступая место хроническим формам, клинически приобретающим характер рецидивирующей инфекции. Выявлено, что у больных ВИЧ-инфекцией ОГ чаще развивается в стадиях 4А—4В ВИЧ-инфекции. Особенностью ОГ явилось затяжное течение и рецидивирование у молодых людей. У 32 из 40 больных поражение кожи протекало с образованием пузырей на фоне выраженной отечности, сопровождалось болезненностью, везикулезные высыпания трансформировались в буллезные у больных с количеством CD4+ клеток ниже 450 в 1 мкл. Показано, что для микст-инфекции ВИЧ + ХГС характерны не только недостаточность Т-клеточного звена иммунитета и фагоцитоза, но и напряжение гуморального звена иммунитета: повышение в крови циркулирующих IgA, IgM, IgG. Результаты клинико-лабораторного обследования больных микст-инфекцией (ВИЧ-инфекция + ХГС) свидетельствуют о взаимовлиянии этих двух нозологических форм. Это подтверждается более выраженным проявлением иммуносупрессии по таким показателям, как уровень в крови CD3+, CD4+, CD16+ и CD20+ клеток. В Санкт-Петербургском центре по профилактике и борьбе со СПИДом и инфекционными заболеваниями (СПб. Центр СПИД) в последние годы отмечено частое обращение больных за медицинской помощью на поздних стадиях ВИЧ-инфекции с множественными тяжелыми оппортунистическими и вторичными заболеваниями. Растет количество пациентов с кандидозом, токсоплазмозом, пневмоцистной пневмонией, вирусными, злокачественными заболеваниями, сохраняется высокий уровень заболеваемости бактериальными инфекциями. Возросла обращаемость пациентов и на ранних стадиях ВИЧ-инфекции, что связано с прогрессированием сопутствующих заболеваний, таких как гнойно-воспалительные осложнения в связи с внутривенным введением наркотиков, обострение хронических вирусных гепатитов и другие. Больные пневмоцистной пневмонией часто выявляются уже на поздней стадии пневмонии, с содержанием количества CD4+ лимфоцитов менее 200 кл/мкл и поступают в стационар в тяжелом состоянии с выраженной дыхательной недостаточностью. Токсоплазменная инфекция у больных с ВИЧ-инфекцией обычно протекает в форме энцефалита, абсцессов головного мозга; генерализованный токсоплазмоз — с поражением различных органов, при снижении количества CD4+ лимфоцитов менее 100 кл/мкл. Генерализованная форма цитомегаловирусной инфекции (ЦМВИ) протекает с поражением слюнных желез, легких, миокарда, желудочно-кишечного тракта, надпочечников, предстательной железы, гипофиза, в 6,6 % наблюдается цитомегаловирусный ретинит. Локализованная форма простого герпеса (генитальный, орофациальный, кожная форма), даже имеющая рецидивирующее течение, развивается при умеренном или легком нарушении иммунного статуса, а распространенная форма, язвенно-некротическая и генерализованная — у больных с показателями CD4+ лимфоцитов 200—300 кл/мкл. Более чем у 20 % лечившихся в стационаре больных с ВИЧ-инфекцией отмечались гнойно-бактериальные процессы, которые характеризовались развитием сепсиса, абсцессов, флегмон, остеомиелитов и других осложнений. Сепсис наблюдался преимущественно у инъекционных наркопотребителей, сопровождался развитием язвенного тромбоэндокардита клапанов и пристеночных подклапанных структур с множественными эмболическими поражениями и септическими инфарктами внутренних органов. Развитие у активных инъекционных наркопотребителей с ВИЧ-инфекцией вирусных гепатитов, ускоряющих формирование цирроза печени, присоединение гнойно-септических осложнений обусловливало неблагоприятный прогноз. По материалам СПб. Центра СПИД, в последние три года госпитализация возросла более чем на 20 %, в 1,6 раза увеличивается количество больных с прогрессирующими и поздними стадиями ВИЧ-инфекции. Стадия вторичных заболеваний требует расширенной и углубленной диагностики с использованием современных методов вирусологических, иммунологических, инструментальных, аппаратных исследований, в том числе КТ, ядерно-магнитное резонансное исследование (ЯМРИ). Нередко возникают сложности в диагностике туберкулеза, генерализованной ЦМВИ, лимфопролиферативных и других заболеваний, что связано с развитием нескольких маркерных инфекций и (или) вторичных заболеваний, наличием поражений различных органов. Е. В. Степановой с соавт. (2004) были изучены особенности клинической картины ВИЧ/СПИДа у 62 больных, 30 из которых умерли от СПИДа. Наблюдаемые пациенты были в возрасте от 26 до 61 года, 75 % составляли мужчины и 25 % — женщины. Генерализованная форма цитомегаловирусной инфекции (16 %) протекала с поражением слюнных желез, легких, миокарда, желудочно-кишечного тракта, надпочечников, предстательной железы, гипофиза, в 2 случаях (3,2 %) наблюдался ЦМВ-ретинит. Простой герпес отмечался в 14,5 % случаев, причем в 9,7 % случаев (у 6 человек) он проявлялся язвенно-некротическим поражением кожи и слизистых оболочек, в 3,2 % случаев (у 2 человек) диагностировался герпетический пневмонит. Синдром истощения установлен у 20 % больных, а ВИЧ-ассоциированная деменция — в 13 % случаев. Поверхностные грибковые поражения были выявлены у 25 % и сопровождались поражением кожи — гладкий микоз кожи, микотическое поражение стоп и онихомикоз. Ведущими причинами смерти пациентов в стадии СПИДа, не получавших антиретровирусную терапию, являлись генерализованная криптококковая инфекция (23,3 %), в том числе криптококковый менингоэнцефалит (13,3 %) и криптококковый сепсис (10 %); генерализованная форма ЦМВ-инфекции (20 %), генерализованный туберкулез (20 %) с гематогенной диссеминацией во все внутренние органы, включая головной мозг, и пневмоцистная пневмония (13,3 %). Диссеминированная CK (ВГЧ-8) и прогрессирующая форма криптоспоридиоза встречались в 6,7 % случаев. H. А. Фарбер и В. М. Жданов приводят результаты сопоставления ЦМВИ и СПИДа по сходным и отличительным проявлениям, дают оценку возможности их специфической лабораторной диагностики, перспектив лечения и профилактики. Эти данные и сегодня представляют определенный исторический интерес. Сходство между ЦМВИ и СПИДом: 1. Значительная частота обнаружения ЦМВИ при СПИДе. Антитела к ЦМВ выявляют у 94—100 % больных СПИДом, что дало повод считать эти антитела «суррогатными маркерами СПИДа» на том этапе, когда специфическая диагностика последнего еще не была разработана. 2. Обнаружение генома ЦМВ в клетках саркомы Капоши при СПИДе и в лейкоцитах больных. 3. Механизмы передачи обеих инфекций могут быть идентичными. К ним в первую очередь относятся половые контакты, так как при обследовании пациентов выявляли этиологические агенты обоих заболеваний в сперме. Английские врачи показали, что у мужчин-гомосексуалистов антитела к ВИЧ и ЦМВ обнаруживаются значительно чаще, чем у мужчин-гетеросексуалистов. Например, антитела к ВИЧ выявлены у 10 из 94 гомосексуалистов и ни в одном случае из 336 гетеросексуалистов, а антитела к ЦМВ, соответственно, у 75 из 94 гомосексуалистов и у 141 из 336 мужчин-гетеросексуалистов. Титры антител к ЦМВ у серопозитивных гомосексуалистов были выше, чем у серопозитивных гетеросексуалистов. Установлена связь обоих заболеваний с трансфузиями крови или ее препаратов, а также наличие механизмов перинатального инфицирования новорожденных при ЦМВИ и СПИДе. 4. Развитие стойкой иммуносупрессии в патогенезе сравниваемых инфекций играет первостепенную роль и касается главным образом повреждения Т-клеточного звена иммунитета. Выявленное избирательное поражение СБ4-лимфоцитов с менее существенными изменениями СИ8-клеток, снижением коэффициента CD4/CD8 также характерны не только для СПИДа, но и для ЦМВИ. В обоих случаях страдает функция натуральных киллеров. Различия между ЦМВИ и СПИДом: 1. Заслуживает внимания высокая частота обнаружения ЦМВИ у больных СПИДом. Однако при этом следует иметь в виду, что ЦМВ отличается убиквитарным распространением и выявляется особенно часто (93 %) у гомосексуалистов, хотя нередко изолируется также и от гетеросексуалистов (54 %). ЦМВ — один из наиболее распространенных вирусов, который может сохраняться в организме человека пожизненно в латентном состоянии. При развитии активных форм инфекции возникает широкий спектр клинических проявлений. К факторам естественной иммуносупрессии, способствующей реактивации ЦМВ, относится состояние беременности, а мощным экзогенным фактором такой провокации является лекарственная иммуносупрессия у реципиентов после пересадки органов и тканей. Вирусы ВИЧ имеют более широкое распространение по сравнению с данными официальной статистики. Вместе с тем вызываемое ими заболевание встречается существенно реже, чем ЦМВИ. Имеются случаи СПИДа без обнаружения ЦМВ. 2. Обнаружение генома ЦМВ в клетках требует осторожной оценки, так как установлена гомология между геномом ЦМВ и ДНК человека. 3. Механизмы передачи могут быть общими при различных вирусных инфекциях. Так, все способы распространения ВИЧ и ЦМВ прослеживаются и при вирусном гепатите В. Однако попытка отождествлять на этом основании СПИД и гепатит В оказалась несостоятельной. 4. Иммунодепрессивный эффект характерен для многих инфекций вирусной этиологии, но по силе повреждающего действия на Т-клетки ЦМВ уступает только возбудителю СПИДа. Принято считать, что ЦМВ индуцирует иммуносупрессию не столь необратимую и протяженную во времени, как при СПИДе, хотя в отдельных случаях эти нарушения и при ЦМВИ проявляются в течение многих лет. Имеются и другие частные различия между обеими инфекциями. Авторы делают вывод о том, что ЦМВИ и СПИД — две обособленные нозологические формы, хотя эти два заболевания весьма часто сочетаются. При этом взаимодействие между двумя вирусами приводит к дополнительной иммуносупрессии. ЦМВ является одним из основных возбудителей вторичных (оппортунистических) инфекций при СПИДе, вызывая при этом риниты, энцефалиты, пневмонии и другие заболевания. Кроме этого, установлено, что практически все бессимптомные носители ВИЧ переносят ЦМВИ. Ассоциация ЦМВ и ВИЧ создает обычно предпосылки для диссеми-нации возбудителей и генерализации ЦМВИ. У таких больных ЦМВИ нередко проявляется высокой лихорадкой, гранулоцитопенией, тромбоцитопенической пурпурой, макулопапулезной сыпью, интерстициальной пневмонией, энцефалитом и язвенными поражениями желудочно-кишечного тракта, которые в совокупности приводят к летальному исходу. Конечно, клиническое предположение о смешанной инфекции ЦМВ и ВИЧ нуждается в верификации специфическими лабораторными методами. Общепринятой классификации клинических форм цитомегалии не существует. Считаем целесообразным выделить следующие клинические формы цитомегаловирусной инфекции: A. Приобретенная цитомегалия: 1) латентная (локализованная) форма; 2) острая мононуклеозная форма; 3) генерализованная форма цитомегалии. Б. Врожденная цитомегалия: 1) острая форма; 2) хроническая форма. B. Цитомегалия у ВИЧ-инфицированных и других лиц с ослабленным иммунитетом. ВГЧ-6. Для пациентов с иммунодефицитными состояниями (больных ВИЧ-инфекцией и СПИДом, пациентов после трансплантации, новорожденных и др.) ГВИ представляет опасность и может приводить к тяжелому течению основного заболевания с летальным исходом. У иммунодефицитных больных ВГЧ-6 может быть причиной лихорадки, нарушения функции и отторжения трансплантата, пневмонии, гепатитов, поражений ЦНС и супрессии костного мозга. ВГЧ-6-инфекция является оппортунистической у реципиентов органов и тканей при трансплантациях и может представлять угрозу для жизни пациентов. Роль ВГЧ-6 как кофактора при ВИЧ-инфекции и СПИДе обеспечивается его способностью инфицировать, реплицироваться и разрушать СБ4+-клетки, а также способностью индуцировать экспрессию CD4 в CD4- СD8+-лимфоцитов, что делает их восприимчивыми к ВИЧ-1-инфекции. У ВИЧ-инфицированных больных ВГЧ-6 обнаруживается в различных тканях (нервной, лимфоидной), у погибших от СПИДа выявляется ДНК ВГЧ-6 в очагах димиелинизированной ткани. Реактивация ВГЧ-6 у ВИЧ-1-инфицированных взрослых пациентов, как правило, не приводит к значительному ухудшению развития основного заболевания. Хотя были описаны случаи возникновения у ВИЧ-инфицированных энцефалитов и пневмоний, связанных с реактивацией ВГЧ-6. У детей, внутриутробно инфицированных ВИЧ-1, первичная ВГЧ-6-инфекция способствовала более быстрому развитию нарушений, вызываемых ВИЧ в течение первого года жизни ребенка. Тем не менее высокие уровни антител к ВГЧ-6 не свидетельствуют о прогрессировании ВИЧ-инфекции и ее переходе в стадию СПИДа. Показано также, что первичная ВГЧ-6-инфекция или реактивация этой инфекции чаще всего наблюдается у больных на терминальной стадии ВИЧ-инфекции. ВГЧ-6 может участвовать в патогенезе фатальных интерстициальных пневмоний у детей. Случаи фатальных инфекций, вызванных ВГЧ-6, были описаны как у иммунокомпетентных лиц, так и у ВИЧ-инфицированных, а также у больных после пересадки печени. Клинике-иммунологическая характеристика саркомы Капоши. Саркома Капоши, обусловленная ВГЧ-8, как онкопатология у больных ВИЧ-инфекцией имеет склонность к агрессивному течению, часто носит генерализованный характер и сочетается с другими инфекциями. Последнее обусловлено тем, что, как правило, CK развивается у больных с выраженным иммунодефицитом, когда в стадии СПИДа число CD4+ лимфоцитов менее 200 кл/мкл. Анализ клиники 8 больных эпидемической CK показал, что заболевание развивается быстро, почти внезапно, характеризуется появлением множественных высыпаний на коже и слизистых оболочках. Поражения локализуются на голове, лице (кончике носа, ушных раковинах), ладонях и туловище. Большие скопления элементов были на внутренней поверхности верхней трети бедер или в надлобковой области, а также в области гениталий; распространенные изолированные элементы на туловище, не переходящие на лицо и конечности. У 1 больного высыпания на голенях и стопах распространились на подошвы, образовав огромные бляшки, причиняя боль при ходьбе. Высыпания у 1 больного располагались симметрично и линейно, группируясь вокруг кожных складок. He удалось выявить факторы, предрасполагающие к тому или иному месту распространения высыпаний. Скорость распространения элементов опухоли, темп прогрессирования болезни и ее осложнения у наблюдаемых больных очень сильно различались. У 2 пациентов появлялись лишь несколько элементов, которые медленно прогрессировали и не доставляли неудобств. У 4 больных CK протекала с обширными быстро прогрессирующими высыпаниями, приводя к возникновению значимых косметических дефектов или функциональных нарушений. Автору не удалось четко выявить зависимость вероятности регрессии при проведении АРВТ от обширности поражения и степени тяжести CR: у 2 пациентов регрессия элементов начиналась через много месяцев после начала АРВТ, а у 2 больных быстрое ухудшение течения CK возникло вскоре после начала эффективной АРВТ. Немногочисленность группы больных не дает достаточных сведений для основополагающих заключений, но неблагоприятный исход болезни у пациентов с CK указывает на такие клинические проявления, как стойкая лихорадка неясного генеза, значительная потеря массы тела, обширность поражения кожи. Из 8 больных у 6 помимо поражения кожи были выявлены поражения внутренних органов: желудка и 12-перстной кишки (4 пациента, в том числе у 1 из них — в сочетании с поражением легких), легких (2 пациента). В качестве примера приводим выписку из истории болезни больного С. Больной С., 33 года, находился на стационарном лечении в ГУЗ ВО КИБ № 1 с 19.05.2010 г. по 16.06.2010 г. Основной диагноз: внебольничная левосторонняя нижнедолевая пневмония ДН 0 (дыхательная недостаточность) средней тяжести. Осложнение: левосторонний плеврит. ВИЧ-инфекция стадия 4В с проявлениями множественных инфекций. Хронический пиелонефрит, обострение. Саркома Kaпоши. Хронический вирусный гепатит С, фаза репликации, минимальной степени активности. Гипохромная анемия легкой степени тяжести. Артериальная гипертензия III степени, риск 2. Поступил с жалобами: слабость, недомогание, быстрая утомляемость, повышение температуры тела, появившиеся изменения на коже лица, туловища и конечностей. Анамнез заболевания: 6 мес. назад на лице, туловище и конечностях появились багровые пятна. He лечился, к врачу не обращался. Примерно 3 мес. назад пятна стали увеличиваться в размерах, появились новые высыпания. Обратился к дерматологу, 2 мес. назад был направлен в ОКИБ № 1. После выписки из стационара обследовался на кафедре кожно-венерических болезней. Был поставлен диагноз ангиосаркома Капоши, который подтвержден гистологически. Центром СПИД больной был направлен в ОКИБ № 1. Анамнез жизни: ХГС с 2002 г., ВИЧ-инфекция с 2001 г., АРВТ получает с 15.04.2010 г. Эпидемиологический анамнез: проявления саркомы Капоши в течение 6 мес. на коже лица, туловище, конечностях; употребление наркотиков — последний раз 5 лет назад (героин): употребляет некипяченую воду. Ухудшение самочувствия связывает со стрессовой ситуацией в семье. Объективный осмотр: состояние больного средней тяжести за счет интоксикации, местных проявлений ангиоматоза; общее питание нормальное: кожные покровы бледные, проявления CK на лице, туловище, конечностях — багровые пятна сливного характера, диаметр 1—1,5 см, отечность кожи; пятна на туловище крупнее — от 1,5 до 4—5 см в диаметре, пятна возвышаются над кожей, плотные, безболезненные при пальпации. Зуда кожи и геморрагических проявлений нет, миндалины не увеличены, на нёбе имеются синюшные пятна. Увеличены периферические лимфатические узлы: затылочные, заднешейные, подчелюстные, подключичные до I размера, безболезненные при пальпации. Дыхание 20 в минуту, жесткое, хрипов нет. Тоны сердца приглушенные, пульс удовлетворительного напряжения, ритмичный, 92 уд/мин, АД 120/80 мм рт. ст. Язык влажный, обложенный белым налетом, живот при пальпации мягкий, болезненный в правом подреберье. Печень выступает на 3—4 см от края реберной дуги, край плотный, селезенка не увеличена. Менингеальных знаков нет; мочеиспускание без особенностей, симптом Пастернацкого отрицателен с обеих сторон. Стул оформленный, цвет темный. Лабораторные и инструментальные исследования: общий анализ крови (ОАК): эритроциты — 3,9*1012/л, гемоглобин — 106 г/л, цветовой показатель — 0,92, тромбоциты — 245*109/л, лейкоциты — 8,0*109/л, лимфоциты — 43 %, эозинофилы — 1 %, нейтрофилы: палочкоядерные — 5 %, сегментоядерные — 40 %, базофилы — 0 %, моноциты — 3 %, СОЭ — 20 мм/ч. Анализ мочи: уд. вес 1014, белок 0,074 г/л, лейкоциты 4—5 в поле зрения, эритроциты 4—2 в поле зрения. Биохимический анализ крови: билирубин 16,0 — 4,0 — 12,0 мкмоль/л, тимоловая проба — 18,6 ед., АлАТ — 0,1 мкмоль/л; протромбиновое время — 17,5 с. Иммунный статус: CD4+ 261, CD8+ 1712, CD4/CD8 0,16, РНК HIV-1 1450 копий/мл. Маркеры: анти-HIV — полож., HbsAg — отр., анти-HCV — полож. Гистологическое исследование № 14839-9: исследован био-птат кожи живота. Описание гистологического препарата: эпидермис атрофичен, в дерме — умеренно густой инфильтрат из гистиоцитов, лимфоидных клеток, фибробластов; множество вновь образованных сосудов, обилие расширенных сосудов, заполненных кровью («кровяные озера»). Диагноз: гистологическая картина свидетельствует в пользу идеопатической геморрагической ангиосаркомы Капоши (ангиоматозный тип). Рентгенография органов грудной клетки: левосторонняя нижнедолевая пневмония, левосторонний плеврит. УЗИ органов брюшной полости: очаговые изменения в структуре печени (гемангиома?), диффузные изменения в поджелудочной железе. Лечение: диета, преднизолон в/в струйно 120 мг, NaCl 0,9 % 400 мл с дексаметазоном — 16 мг, лазикс 4,0 в/в струйно, дибазол 1 % — 4,0 с папаверином 2 % — 2,0 в/м при повышении АД, капотен 25 мг сублингвально при повышении АД, амикацин 500 мг 3 р/д в/м, этамзилат 12,5 % — 2,0 в/м 2 р/д, аскорбиновая кислота 5 % — 10,0 в/в струйно, аскорутин 2 т. 3 р/д, проспидин 100 мг 1 р/д в/м, витамины B1, B6 2,0 в/м через день, B12 500 мг в/м, фосфоглив 2 кап. 3 р/д, трентал 1 т. 3 р/д, эпивир 0,05 2 р/д, зерит 0,4 2 р/д, презиста 0,6 2 р/д, ритоновир 0,1 2 р/д, ципрофлоксацин 1 т. 2 р/д. Анализируя лабораторные показатели у больных саркомой Капоши (табл. 64), можно отметить, что имеют место выраженные изменения в гемограмме, наиболее закономерными для больных являются анемия (гемоглобин 104,0 ± 7,18 г/л), снижение содержания эритроцитов (3,2 ± 0,64 г/л), тромбоцитопения (152,0 ± 16,4*109/л), что связано с непосредственным действием ВИЧ на кроветворную систему и с аутоиммунной агрессией. Имеют место также моноцитоз (12,0 ± 2,02 %), нейтропения (45,5 ± 2,57 %), относительная лимфопения (24,5 ± 4,63 %), резкое повышение показателя СОЭ (39,5 ± 8,53 мм/ч). При изучении некоторых показателей иммунной системы выявлено глубокое угнетение иммунитета, проявившееся в резком снижении количества CD4+ Т-лимфоцитов при нормальном соотношении CD8+ клеток и, соответственно, в снижении индекса CD4/CD8 (0,55 ± 0,08), что объясняется прежде всего характерным избирательным действием самого ВИЧ на CD4+ Т-лимфоциты. Наряду с изменением в Т-клеточном звене наблюдается нарушение функции гуморального иммунитета, снижается количество В-лимфоцитов. Таким образом, у больных CK как суперинфекции ВИЧ/СПИД имеются изменения в иммунном статусе. Выраженный иммунодефицит при ВИЧ-инфекции обусловливает тяжелую симптоматику клинических проявлений и быстрое прогрессирование CK, приводящие к летальному исходу. Коррелятивный анализ показал, что к лабораторным показателям, которые позволяют прогнозировать продолжительность жизни ВИЧ-инфицированных пациентов с CK, относятся количество лимфоцитов CD4 (r = 0,76), иммунорегуляторный индекс — отношение CD4/CD8 (r = 0,62), гематокрит (r = 0,53), а также уровень сывороточного ВИЧ-антигена р24 (r = 0,48). Наблюдения И. В. Макаровой, данные анализа историй болезней пациентов, ранее находившихся в стационаре по поводу ВИЧ/СПИД с клиникой CK, позволили систематизировать клинико-лабораторные показатели, определяющие прогноз течения болезни (табл. 65). Из 8 больных с CK у 7 продолжительность жизни с момента клинических проявлений болезни не превышала 1 года, в том числе у 4 пациентов она была менее 6 мес. Причем непосредственной причиной смерти была не саркома Капоши, а прогрессирующее течение СПИДа с присоединением других вторичных инфекций. Тем не менее наличие CK может служить оценочным показателем неблагоприятного прогноза ВИЧ-инфекции. | |
|
| |
| Всего комментариев: 0 | |