10:33 Механизмы репродукции вирусов герпеса | |
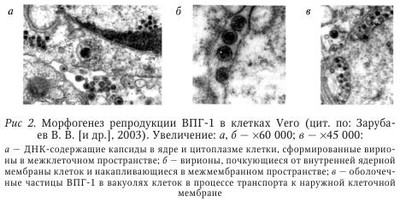
Изучение патогенеза вирусных инфекций, в том числе и герпеса, показало, что формы взаимодействия вируса с организмом хозяина могут быть различны в зависимости от продолжительности пребывания возбудителя в последнем. В ходе вирусного цикла вирус проходит литическую и латентную фазы. При непродолжительном присутствии вируса в организме инфекционный процесс может протекать либо в острой (короткий инкубационный период с последующим развитием характерных симптомов), либо в инаппарантной (бессимптомной) форме. Длительная персистенция вируса в организме проявляется тремя основными формами инфекции: — латентной (бессимптомная персистенция возбудителя, при которой нарушается полный цикл репродукции вируса и он находится в клетках хозяина в виде субвирусных структур); считают, что может происходить репродукция зрелого вируса с выделением его во внешнюю среду; — хронигеской (персистенция вируса манифестируется клинической симптоматикой заболевания в течение длительного времени); — медленной вирусной, которая характеризуется длительным (месяцы и годы) инкубационным периодом с последующим медленным прогредиентным течением и развитием тяжелых клинических симптомов и заканчивается смертью больного. При этом необходимо иметь в виду, что формы с кратковременным и длительным (персистенция) пребыванием вируса в организме нередко связаны между собой — одна форма инфекции переходит в другую. Доказано развитие медленных вирусных инфекций, обусловленных ВПГ (подострый герпетический энцефалит), ВЭБ (хронический инфекционный мононуклеоз, лимфома Беркитта), ЦМВ (цитомегаловирусное поражение мозга), ВГЧ-8 (саркома Капоши). Вирус простого герпеса (ВПГ). Репродукция ГB в чувствительных клетках — многоэтапный процесс, протекающий с участием различных вирионных, клеточных, вирусиндуцированных и вирус-модифицированных белков. На поверхности вириона представлены 11 белков, 10 из которых гликозилированы (gB—gM). Гликопротеины gB, gD и gE взаимодействуют с молекулами рецепторов на наружной мембране клеток-мишеней. После слияния вирусной и клеточной мембран происходит высвобождение белков тегумента в цитоплазму. При этом белок вируса ВПГ подавляет трансляцию клеточных белков, тогда как a-TIF проникает в ядро и инициирует транскрипцию ранних (а) генов ВПГ. Капсиды транспортируются к ядерным порам, где вирусная ДНК (вДНК) высвобождается из капсидов, проникает в ядро и замыкается в кольцо. Белки — продукты трансляции a-генов ВПГ — проникают обратно в ядро и индуцируют синтез белков b-генов (вирусспецифическая ДНК-полимераза и тимидинкиназа, необходимые для синтеза ДНК ВПГ). На этой стадии хроматин деградирует и распределяется вдоль внутренней поверхности ядерной мембраны. Ядрышки распадаются: у-цикл репликации приводит к синтезу структурных белков вирионов (играют важную роль в иммунопатогенезе ГИ) и образованию пустых капсидов, в которые упаковывается в ДНК. Такие капсиды покрываются рецепторным белком. Вирусные гликопротеины и белки тегумента накапливаются в клетке и образуют впячивания на клеточных мембранах. Капсиды, содержащие ДНК и дополнительные белки, прикрепляются к впячиваниям и покрываются оболочкой. Сформировавшиеся вирионы аккумулируются в эндоплазматические ретикулумы и транспортируются во внеклеточное пространство. Основными этапами развития ГИ являются: первичная инфекция кожи и слизистых, «колонизация» и острая инфекция ганглиев с последующим установлением латентности, когда только вирусная ДНК, находящаяся в ядрах нейронов, свидетельствует о наличии инфекции. По окончании острой фазы инфекции свободный вирус простого герпеса (ВПГ) более не обнаруживается в чувствительном ганглии. Механизмы, определяющие переход из острой фазы инфекции, когда вирус не удается обнаружить в гомогенатах ганглия, пока не выяснены. Этот переход происходит параллельно с развитием иммунной реакции хозяина, что уменьшает размножение вируса в коже, снимает сигнал, и клетки ганглия становятся непермиссивными — устанавливается латентная инфекция. Обнаружение вируса герпеса в ганглиях людей, перенесших в прошлом инфекцию ВПГ, говорит о реактивации инфекции, которая может протекать как бессимптомно, так и с развитием поражений слизистых и кожи. У людей бессимптомное тегение, так же как и клинически выраженный рецидив, наблюдается после микронейрохирургического вмешательства на тройничном нерве. Реактивация ВПГ часто встречается у лиц, получающих иммунодепрессанты (такие, как цикло-фосфамид), например, после трансплантации органов или при УФ-облучении. Активизирующий эффект перечисленных и ряда других факторов неразрывно связан с нарушением содержания в клетке циклоаденозинмонофосфата (цАМФ), играющего большую роль в реализации разнообразных внутриклеточных процессов. В инфицированной ВПГ клетке резко снижается количество цАМФ. Нарушение равновесия в инфицированной клетке под влиянием провоцирующих факторов приводит к усилению репликации вируса, что клинически проявляется обострением. Затем между вирусом и клеткой устанавливается новое равновесие, и образование активного ВПГ прекращается до тех пор, пока какой-либо новый провоцирующий фактор не нарушает этого баланса. По мнению некоторых авторов, от 30 до 50 % пациентов кожно-венерологических диспансеров являются скрытыми носителями вирусов герпеса. Обследование гистохимическим методом репродуктивных секретов 57 мужчин молодого возраста с хроническими воспалительными заболеваниями внутренних половых органов выявило у 39 из них (68,4 %) специфический маркер ВПГ, у 41 (71,9 %) — маркеры ЦМВИ. Сочетание вирусов имелось у 15 (26,3 %) больных. Важно отметить, что бессимптомное (субклиническое) течение ГВИ представляет угрозу инфицирования полового партнера, в процессе репликации ВПГ может инфицировать половые клетки, нарушать сперматогенез, что в конечном счете проявляется нарушением генетического аппарата. He исключено также встраивание вирусной ДНК в генетический аппарат гамет. В 1999—2001 гг. при обследовании 100 мужчин с ИППП субклинические формы ГГ были выявлены у 12 % в 1999 г., у 18 % в 2000 г. и у 27 % в 2001 г. Известны две альтернативные теории (гипотезы), предложенные для объяснения механизмов персистенции ВПГ, которые допускают развитие рецидивов на основе статического либо динамического состояния вируса. Согласно статической гипотезе, вирус герпеса находится в клетках паравертебрального сенсорного ганглия в интегрированном или свободном непродуктивном состоянии. Под влиянием «пускового фактора» вирус активируется и перемещается из ганглия по аксону периферического нерва в эпителиальные клетки, где реплицируется. Предполагается, что этому во многом способствуют восприимчивость клеток и ослабление иммунологического контроля. Динамическая гипотеза предусматривает постоянную репликацию и выделение вируса герпеса из ганглия. Достигая по нерву кожи, ВПГ вызывают микрофокусы инфекции, сдерживаемые механизмами защиты, что предупреждает рецидивы или ослабляет их проявления. На развитие рецидивов оказывает влияние состояние местного иммунитета, угнетение которого способствует репликации достигшего кожи вируса. Поскольку активность вирусного цикла находится под контролем клеток врожденного и приобретенного иммунитета, рассмотрим фазы развития клеточного иммунного ответа (общие положения также верны и для других ГВ). В ходе развития иммунного ответа Т-клетки проходят следующие фазы: 1) экспансии; 2) контракции: 3) поддержания иммунологической памяти; 4) вторичного ответа. Известно, что после первичного контакта с антигеном Т-клетки пролиферируют более 10 раз (фаза экспансии), что приводит к увеличению их количества и появлению у них эффекторных свойств. После этого Т-клетки, как правило, подвергаются апоптозу, что вызывает резкое сокращение их численности (на 90—95 %) во всех тканях организма (фаза контракции). Завершение фазы контракции сменяется формированием устойчивого пула долгоживущих Т-клеток памяти, которые присутствуют в лимфоидных и нелимфоидных тканях, способных в случае обнаружения причинного антигена быстро отвечать на него. Наконец, во время повторного контакта (фаза вторичного ответа) с исходным антигеном Т-клетки памяти снова подвергаются быстрой пролиферации. Другим важным клеточным компонентом протекции при ВПГ-инфекции являются НК-клетки. До недавнего времени для НК-клеток, которые по своей литической активности напоминают CD8 Т-клетки, были описаны лишь фазы экспансии и контракции, поскольку считалось, что зрелые НК-клетки представляют конечную стадию дифференцировки и не способны к самоподдержанию (период полужизни -2 нед.). Однако на основании последних экспериментальных работ, проведенных на модели ЦМВ инфекции у мыши, установлено, что НК-клетки также обладают способностью к формированию долгоживущих НК-клеток (по типу “НК-клетки памяти”) и проявляют признаки иммунологической памяти при вторичном ответе на ЦМВ-инфекцию. В подтверждение важности данных о защитной роли НК-клеток памяти может также служить недавнее ретроспективное исследование пациентов с эпидемическим нефритом, вызванным вирусом Puumala семейства хантавирусов, у которых было обнаружено повышенное содержание НК-клеток более чем через 2 мес. после инфицирования при полном отсутствии виремии. Кроме того, на мышах также показано, что такие НК-клетки памяти позже локализуются преимущественно в печени за счет экспрессии на них СХСR6-рецептора для хемокина CXCL16, синтезируемого синусоидальным эндотелием печени. При вторичном введении исходного специфического антигена (вирусы, гаптены) НК-клетки памяти могут выходить из печени в кровоток и достигать мест присутствия антигена на периферии. Примечательно, что у ВИЧ-инфицированных пациентов длительный контроль за репликацией вируса ассоциирован также с полиморфизмом в рецепторе CXCR6 (rs2234358), а НК-клетки способны лизировать ВИЧ-инфицированные клетки-мишени in vitro. Возможно, что между фенотипом НК-клеток и их способностью к длительному поддержанию в отсутствие причинного антигена может существовать прямая связь. Однако в настоящее время таких данных нет. Следовательно, для успешного формирования длительного про-тективного иммунитета в конкретных случаях может потребоваться разработка новых типов вакцин, способных, помимо индукции T-и В-клеток памяти, приводить к индукции и НК-клетки памяти (например, включение в вакцины рекомбинантных IL-15 для поддержания гомеостатической пролиферации НК-клеток и IL-12 для запуска их вирус-индуцированной пролиферации и выживания). Большое количество экспериментальных исследований на животных помогает изучить различные стороны проявления ГИ. Первичное инфицирование ВПГ вызывает латентную инфекцию спинальных и церебральных ганглиев, куда вирус попадает из входных ворот инфекции эндоневрально, периневрально, интрааксонально или по шванновским клеткам. Помимо нейрогенного пути распространения ГИ большое значение имеет гематогенный путь ее распространения в результате выраженного эритропизма ВПГ, вследствие которого происходит заражение новых клеток. Кроме того, ВПГ, по-видимому, может инфицировать лейкоциты и тромбоциты, причем в первых наблюдаются грубые повреждения хромосом и большие скопления антигена ВПГ. Становление латентной инфекции связано со структурными изменениями в вирусном геноме. Это принципиально важное положение было установлено методами рестрикционного анализа и блоттинг-гибридизации и меченными 32P вДНК при сравнении вирион-ной ДНК эталонного ВПГ-1. Известно, что цикл репликации ВПГ имеет отчетливо выраженные стадии морфологических изменений в инфицированной клетке. На рис. 2 представлен морфогенез репродукции ВПГ-1 в клетках Vero. Немаловажную роль в патогенезе ГИ играет выведение ВПГ со слюной, мочой, калом. Явление вирусурии открыто еще в 1937 г. Л. А. Зильбером. Выделение специфических маркеров ВПГ в эякуляте мужчин репродуктивного возраста, страдающих хроническими воспалительными заболеваниями внутренних половых органов, составляет от 68 до 80 %, ЦМВ — 72 %, смешанных маркеров — 26 %. | |
|
| |
| Всего комментариев: 0 | |