10:43 Бронхолегочная дисплазия. Неонатальный и постнеонатальный мониторинг | |
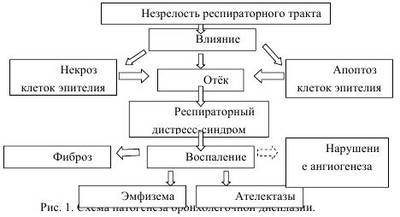
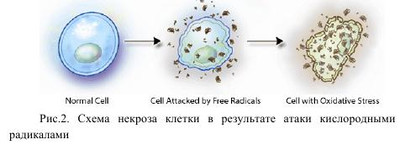
Расширение знаний о причинах расстройств адаптации, улучшение неонатальной реанимации значительно снизило смертность новорожденных. Наряду с этим педиатрам приходится констатировать факт роста числа хронических заболеваний, связанных с «катастрофами» неонатального периода. Одним из них является бронхолегочная дисплазия. На современном этапе бронхолегочная дисплазия (БЛД) рассматривается, как полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом недоношенных, в результате интенсивной терапии респираторного дистресс-синдрома и /или пневмонии. За последние 30 лет возросла доля стран (на 20%), где рождаются дети с низкой и очень низкой массой тела. В Украине удельный вес преждевременных родов составляет 5%, в Европе - 5-9%, а в США он достигает 12-13%...10-12% новорожденных Украины имеют массу тела менее 2500 грамм, что приближается к верхней границе всемирного показателя. По данным мировой статистики раньше 28 недели гестации рождается 5% детей, 15% - на 28-31 неделе беременности, а 20% - в 32-33 постконцептуального периода. Из них БЛД формируется у 62% детей с весом до 1000 грамм, у 39% новорожденных с массой тела от 1000 до 1500 грамм и в 10% младенцев с массой при рождении более 1500 грамм. В 2006 году Украина сделала значительный шаг к уменьшению неонатальной смертности. Благодаря средствам респираторной терапии, тепловой и метаболической поддержки улучшен уровень неонатальной помощи. Вместе с тем неуклонно возрастает число недоношенных детей, переживших респираторный дистересс-синдром и сформировавших бронхолегочную дисплазию. В этом аспекте внимание ученых и врачей сосредоточено на обеспечении качества жизни такого ребенка. В 2007 исследователи Института медицины США определили ежегодные расходы на лечение и профилактические мероприятия недоношенных новорожденных больных БЛД. Так, на медицинское обслуживание 550000 недоношенный с БЛД потрачено около 26 миллиардов долларов, что составляет 47 000 долларов на одного пациента, в то время как на доношенного новорожденного учреждениями здравоохранения ежегодно тратится не более 1000 долларов США. Учеными департамента педиатрии Case Western Reserve University, США в результате многомерного анализа доказано снижение показателей роста, массы и индекса массы тела у детей с БЛД при достижении 8-ми летнего возраста. У таких пациентов достоверно чаще регистрируется респираторная патология с обструкцией дыхательных путей, в 2,6 раз выше риск дыхательной недостаточности, которая требует искусственной вентиляции легких. Дети с бронхолегочной дисплазией имеют дефицит экспрессивной и рецептивной слуховой и зрительной функций у детей с БЛД. Показана более низкая оценка IQ у пациентов с БЛД. Таким образом, дети с бронхолегочной дисплазией требуют особого систематизированного подхода к мониторингу их развития, для воспитания полноценного члена общества. ЭТИОЛОГИЯ. В историческом плане главную роль в развитии БЛД отводили высокому проценту кислорода при проведении искусственной вентиляции легких. В дальнейшем обратили внимание на более частое развитие БЛД при проведении искусственной вентиляции легких (ИВЛ) с высоким «пиковым давлением». На сегодняшний день многие клиницисты склонны считать, что основным индуктором повреждения легочного интерстиция является преимущественно волюмотравма. Дополнительными, но не менее важными факторами риска развития БЛД считаются: 1. Факторы, приводящие к задержке формирования легких: олигоамнион; хроническая гипоксия плода; внутриутробная инфекция; аномалии развития плода; метаболические сдвиги. 2. Факторы, способствующие преждевременному рождению ребенка: склонность к невынашиванию у матери; прерывание беременности. 3. Состояние новорожденного, требующее респираторной поддержки: недоношенность, дефицит сурфактанта; респираторный дистресс-синдром; асфиксия; шоковые состояния; синдром мекониальнои аспирации, с многократным лава жеванием трахеобронхиального дерева во время терапии; недостаточная активность антипротеаз; внутриутробная и неонатальная пневмония; персистирующий фетальный кровоток с лево правым шунтом и легочной гипертензией. Факторы, приводящие к задержке формирования легких Олигоамнион. Важным условием для предотвращения развития бронхолегочной дисплазии является адекватный объем и давление амниотической жидкости. Около 8% беременных имеет малый объем околоплодных вод, а у четырех процентов диагностировано маловодие. Наиболее часто маловодие развивается при нарушении плацентарного кровообращения, подтекании амниотической жидкости, почечной недостаточности плода. Неоднократными исследованиями доказано влияние количества амниотической жидкости на рост легочного интерстиция. Амниотическая полость начинает заполняться жидкостью после 2 недель гестации. По своему составу похожа на плазму: имеет соответствующее количество белков липидов, углеводов, фосфолипидов, мочевины и электролитов, которые способствуют развитию плода. С 8-11 недели в околоплодных водах начинает преобладать моча, которую заглатывает плод на поздних сроках беременности, с мочой к нему поступает доля жидкости и необходимые вещества для дальнейшего органогенеза. Важная роль мочи, как источника пролина гетероциклической аминокислоты, которой значительно наделен основной белок соединительной ткани - коллаген. Основной функцией коллагена считается поддержка нормальной архитектуры легких и межклеточного матрикса. Он широко распространен в мезенхиме бронхиального дерева, междольковых перегородок и альвеолярного интерстиция. При этом уменьшение критического объема, а соответственно и давления амниотической жидкости сопровождается обворовыванием трахеи и легких, уменьшением внутренне альвеолярного секрета, повышает сопротивление интерстиция при растяжении. Снижение растяжения легочной ткани подавляет альвеоляризацию легочной ткани, замедляет истончение интерстиция и синтез сурфактанта, что является основой респираторных расстройств при рождении. Гипоксия. Для плода является физиологичной более низкая концентрация кислорода, что является стимулятором правильного онтогенеза. Наравне с тем, при снижении р02 ниже предельных показателей, что наблюдается при хронической гипоксии плода возникают диаметрально противоположные сдвиги баланса цитокинов, гипоксиеиндуцированного фактора-1 (HIF-1) и ростовых факторов (VEFR, GFR и TGF-(H), что приводит к замедлению альвеоляризации и синтеза сурфактанта Алокоголь. Доказано, что дети от матерей употребляющих алкоголь чаще развивают респираторные расстройства с формированием БЛД, как за счет слабости центральной регуляции дыхания, мышц диафрагмы, так и дискоординации формирования легочной ткани. Метаболические нарушения. На сегодняшний день вероятна, однако не до конца изучена роль метаболических нарушений в формировании бронхолегочной дисплазии. В Областном центре диагностики и лечения бронхолегочной дисплазии г. Харькова наблюдается около 80 детей. Из них наследственной болезни обмена обнаружены у 40% пациентов. Такие результаты наводят на мысль о необходимости клинико-морфологического и специального биохимического исследования каждого больного с бронхолегочной дисплазией, с целью выявления метаболических нарушений их диетической и медикаментозной коррекции. Аномалии развития плода. Вопрос нарушения центральной регуляции дыхания обусловлены частым сочетанием их с бронхолегочной дисплазией у пациентов, находящихся под наблюдением в центрах перинатальной патологии. Дети с поражением ЦHC имеют рецидивирующие респираторные проблемы. Эксперименты новозеландских ученых в 2007 году доказали, что повреждение проводящих путей на уровне шейного отдела спинного мозга в третьем триместре беременности ведет к снижению массы легких при рождении и уменьшения суммарной дезоксирибонуклеиновой кислоты в дистальном отделе респираторного тракта. Они пришли к выводу, что патогенетические основы дисплазии легких у таких детей лежат в недостаточном нейрореспираторном драйве и отсутствии адекватной тяги, которая в свою очередь, индуцирует правильную альвеоляризацию респираторного тракта. Дальнейшие исследования доказали генетические основы нарушения экспрессии гена VEGF на эндотелии легочных сосудов и сосудов центральной нервной системы у плода человека, который может объединять в единые патологические механизмы респираторную и нервную систему. Наглядным примером является brain-lung-thyroid syndrome, обусловлен мутацией гена Nkx2.1 и тиреоидного трансформирующего фактора (TTF-1) с клиническими проявлениями гипотиреоза, респираторного дистресс-синдрома и хореи. Таким образом, центральная нервная система играет важную роль в онтогенезе и дифференциации легких за счет поддержания дыхательных движений у плода и индукции транскрипционных факторов направленных на формирование легких стимуляцией тяги легких. Нарушение механики дыхания. Внутриутробные дыхательные движения имеют чрезвычайное физиологическое значение, они способствуют притоку крови к сердцу плода, стимуляции альвеоляризации легочной ткани и роста сосудов. Деформация каркаса грудной клетки ограничивает внутриутробные дыхательные движения и рост легких, что наблюдается у детей с тяжелой патологией ЦНС. Внутриутробная инфекция. Контаминация дыхательных путей уреаплазмой, хламидией, микоплазмой, цитомегаловирусом наиболее часто ассоциируется с развитием воспаления, цепляет амнионе и амниотическую жидкость. Указанные возбудители могут вызывать хориоамнионит и инфекционное воспаление дыхательных путей. Патогенез персистирующей инфекции реализуется через индукцию синтеза TNFa, IL-1, IL-6 ИЛ-8 ИЛ-11 с запуском воспалительной реакции. Вместе с тем активация провоспалительных цитокинов дискоординирует физиологическую последовательность факторов пульмонального роста и диференцировки, нарушает альвеоляризацию и васкуляризацию, а репарация происходит через пролиферацию фибробластов. Австралийские ученые в 2010 году доказали достоверно более частое повреждение легких при проведении ИВЛ у ягнят инфицированных уреаплазмой в сравнении со здоровыми недоношенными овцами. Ученые США в 2010 году пришли к выводу, что воспаление кроме угнетения альвеоляризации может приводить к образованию аберрантных альвеолярных капилляров в легких пациентов с БЛД. Внутриуробная инфекция и преждевременные роды. Пятьдесят процентов преждевременных родов обусловлено инфицированием. Патоген проникает в матку в силу несостоятельности защитных механизмов, запускает синтезом провоспалительных цитокинов, которые в свою очередь индуцируют простгландины Е2, вызывая сокращение мускулатуры матки и преждевременные роды. Склонность к невынашиванию. Известно, что не менее чем у половины женщин преждевременные роды возникают без видимых факторов. Очевидно, что преждевременные роды связаны с генетическими факторами, среди которых имеет значение и функциональный полиморфизм генов провоспалительных цитокинов, обуславливая индивидуальные колебания уровней синтеза и секреции. Доказана связь полиморфизма генов TNF (-308), IL-1в (3953) те IL-6 (-174). А также гена TLR-4 с преждевременными родами. Наследственная или приобретенная нехватка продукции IL-10 может быть фактором раннего начала родов за счет отсутствия надлежащего контроля за продукцией провоспалительных цитокинов. В возникновении преждевременных родов имеет значение не только локальное увеличение синтеза цитокинов в плаценте, а также их уровень в плазме крови матери, что важно для понимания патогенеза преждевременных родов на фоне стрессовых факторов. Возможно будущее в пролонгировании беременности по ингибированию провоспалительных цитокинов, для предотвращения каскада процессов, приводящих к преждевременным родам. Недоношенность и незрелость. В настоящее время незрелость считается главным способствующим фактором развития бронхолегочной дисплазии. При этом чем выше степень недоношенности тем более значительные и необратимые патологические изменения. Становления дыхательной системы у недоношенных младенцев является самым слабым звеном в системе общего адаптации к вне утробного жизни: только в конце 22 недели беременности создаются условия для осуществления удовлетворительного газообмена. У недоношенного несовершенными являются механизмы кондиционирования вдыхаемого воздушной смеси, закрытие верхних дыхательных путей во время глотания, недостаточная координация вдоха и глотания, особенно у детей до 32 недель беременности. Чем меньше срок гестации тем больше расстояние между клетками капилляров и альвеол, следовательно меньшие возможности драйва кислорода в кровеносное русло. Неэффективными являются мышечные сокращения, слюноотделение и альвеолярно-бронхиальный поток воздуха, отсутствует адекватный кашлевой дренаж, что затрудняет эвакуацию секрета трахеобронхиального дерева. Все новорожденные с IY степенью недоношенности (рожденные до 29 недели беременности) в первую очередь страдают от замедленного альвеол-капиллярного драйва, обусловленного утолщенным интрестицием. Все это обусловливает аспирационно-обструктивные нарушение дыхания, возникновение ателектаза в легких, формирование участков нарушением микроциркуляции, воспаление с развитием фиброза легочной ткани. Следует акцентировать внимание, что факт преждевременных родов не всегда является обязательным для диагноза БЛД. Доношенные дети с задержкой внутриутробного развития за счет инфекционного фактора, пневмонии, метаболических нарушений на фоне генетических заболеваний, врожденными пороками развития центральной нервной системы, а также с вынужденной длительной экспозицией кислорода во время реанимации тоже развивают бронхолегочная дисплазию. Дефицит сурфактанта. Одной из ведущих причин развития респираторных расстройств и запуска воспалительного процесса является недостаточность синтеза сурфатканта. Сурфактантая система ребенка рожденного преждевременно неспособна к поддержанию нормальной проницаемости аерогематического барьера, обмена воды и микроциркуляции. За счет небольшого количества сурфактанта и его нестабильности у недоношенного ребенка альвеолы невозможны уменьшить поверхностное натяжение и благоприятные к разрушению. Персистирующие фетальные коммуникации с лево-правым шунтом на неразвитых подлежащих неблагоприятном ятрогенного влияния легких ухудшают легочную микроциркуляцию, замыкая порочный круг патогенеза бронхолегочной дисплазии. По наблюдениям перинатальных центров около 30% детей больных БЛД имеют сохраненные фетальные коммуникации. Открытый артериальный проток диагностируется у 57 детей из 100000 доношенных, в то время как каждый третий недоношенный с массой тела от 501 до 1500 грамм и 55% новорожденных, чья масса <1000 грамм имеет ОАП. В условиях развития пневмонии, респираторного дистресс-синдрома, мекониальнои аспирации или проведены искусственной вентиляции легких сохраняется шунтирование крови слева направо, увеличивается легочный кровоток. При условии физиологических для недоношенного уменьшенного онкотического давления и повышенной проницаемости капилляров открытого артериального протока увеличивает вероятность интерстициального и альвеолярного отека, и повышения резистентности легких. Последнее обусловливает необходимость вентиляции с повышенными объемами, давлением и концентрацией кислорода, формируя бронхолегочную дисплазию. Открытое овальное окно в обычных условиях не способствует гемодинамических нагрузке малого круга кровообращения. Наравне с тем доказано, что при присоединении пневмонии или бронхита у детей с БЛД легочная гемодинамика значительно ухудшается. Таким образом, механизмы закрытия ОАП зависят от гестационного возраста и кислорода, а также готовности ферментных систем ребенка. Интегративная роль медиаторов при закрытии ОАП их связь с патологическими состояниями как в неонатальный период и в раннем возрасте следует изучить в дальнейших экспериментах и перспективных клинических исследованиях. ПАТОГЕНЕЗ. Бронхолегочная дисплазия представляет собой полиетиологическое заболевание главные элементы патогенеза которого, имеют запрограммированный ход: влияние триггеры (-ов) - некроз / апоптоз клеток эпителия - отек - воспаление - фиброз / нарушение альвеоляризации и ангиогенеза (рис. 1). Хронологически развитие бронхолегочной дисплазии начинается с типичного респираторного дистресс-синдрома, обусловленного сверхпороговым влиянием триггеров (I стадия). В легких новорожденного на протяжении первой недели жизни возникает интерстициальный отек, с накоплением воды и белков из-за образовавшихся в альвеолокапиллярной мембране брешей в результате некроза (реже апоптоза) клеток альвеолярного эпителия и эндотелия капилляров (II стадия). Некроз распространяется очень быстро и в течение первой недели затрагивает большинство бронхиол. He выдерживают массивного удара биологически активных веществ и компоненты альвеоло-капилярной мембраны: эпителий, интерстиций и эндотелий. Количество эластина резко сокращается, а гладкая мускулатура альвеол и бронхов гипертрофируется. При благоприятном исходе респираторного дистресс-синдрома процесс переходит в III стадию: на второй-третьей недели жизни отмечается приток макрофагов, плазмоцитов и фибробластов. С четвертой недели развивается интерстициальный и перибронхиальний фиброз в сочетании с очагами эмфиземы, появляются зоны ателектаза (IY стадия). В стенках альвеол увеличивается число ретикулярных коллагеновых, эластических волокон с нарушенной структурой, что позволяет окончательно судить о развитии бронхолегочной дисплазии у новорожденного. Триггеры формирования бронхолегочной дисплазии: • Химические, механические раздражители (баро-, волюмотравма, низкая температура вдыхаемой смеси, синдром мекониальной аспирации) • Гипероксия (ингаляции высокими дозами кислорода) • Гипоксия (асфиксия, шок) Волюмотравма / реже баротравма обусловлена перерастяжением легочной ткани, разрывом альвеол и разрушением эластина, что запускает каскад воспалительной реакции с притоком лейкоцитов и высвобождением активных форм кислорода и развитием интерстициального отека с накоплением воды и белков. Искусственная вентиляция легких, изменяет нормальное соотношение воздуха в легких. Согласно математической модели Шика-Сидоренко при спокойном вдохе конвекционное движение воздуха по дыхательным путям замедляется по мере разветвления бронхиального дерева и на уровне кондуктивной зоны прекращается. В бронхиолах и альвеолах перемешивание воздуха по дыхательным путям замедляется только за счет диффузии газов - броуновского движения молекул. В связи с большей скоростью газового потока при HBЛ происходит смещение зоны конвекционного движения в сторону альвеол и уменьшение зоны диффузионного газообмена. Кроме того, при самостоятельном дыхании в большей степени вентилируются периферические участки легких, которые прилегают к движущейся диафрагме и грудной стенке. При HBЛ, наоборот, наибольшая вентиляция происходит в перибронхиальных и медиастинальных участках, где в первую очередь создается положительное давление во время искусственного вдоха. Наравне с тем бронхолегочная дисплазия имеет гетерогенную константу времени в разных областях легких, а аэродинамическое сопротивление может значимо возрастать и периодически переходить в бронхоспазм. Неравномерная вентиляция способствует перерастяжению и ателектазам отдельных участков легких. Учеными американского торакального общества приведены данные о влиянии продолжительности вентиляции с умеренным давлением кислорода на морфологию и функцию легких детей у рожденных в 23-29 недель, которые были на искусственной вентиляции легких в 36-39 недель постменструального периода. При патологоанатомическом исследовании у них обнаружено двукратное увеличение объема воздуха в паренхиме и шестидесяти процентное расширение микроциркуляторного русла, что объясняется увеличением пролиферации клеток эндотелия. Анатомическая структура легких была сохранена. Прекращение микрососудистого роста у недоношенных младенцев выявлено не было. Приведенные данные показывают необходимость выбора «щадящей» ИВЛ с относительно низкими дыхательными объемами (не более 4-6мл/кг) средними или высокими показателями ПДКВ (4-8 мм вод.ст) и продленным временем вдоха и выдоха. Гипероксия. Антиоксидантная защита развивается во время внутриутробной жизни сравнительно поздно, и даже кратковременная гипероксия вызывает длительный и потенциально опасный оксидативный стресс. Вдыхание воздушной смеси с высокими концентрациями кислорода обуславливает образование его активных форм из-за способности последнего принимать электрон на внешнюю орбиталь в результате чего синтезируется супероксид и перекись водорода, а также гидроксил - мощный истребитель даже ДНК ядра. Активные формы кислорода (АФК) физиологичны и жизненно необходимы человеку, так как выполняют бактерицидную функцию и являются одним из ведущих механизмов введения в апоптоз поврежденной или чужеродной клетки. Однако, при их высоких концентрациях в респираторном тракте незрелого ребенка происходят необратимые повреждения клеток не только эпителия, а и всех слоев альвеоло-капилярной мембраны и бронхов. При контакте с эпителием легких и эндотелием сосудов активные формы кислорода разрушают фосфолипидный слой мембраны, блокируют АТФ-азукальциевой помпы и кальцийаккумулирующую функцию митохондрий. Приток кальция активирует эндонуклеазы которые расщепляют ДНК, фосфолипазы отвечающие за разрушение мембран и протеазы способствующие деструкции и перевариванию цитоскелета. Наравне с активацией «ферментов-разрушителей» резко падает уровень окислительно-восстановительных ферментов (например - сукцинатдегидрогеназы). Так запускается необратимый процесс клеточной генетически неконтролируемой гибели - некроз (рис. 2.). Хроматин ядра конденсируется в большие грудки, ядро становится уменьшенным, сморщенным, плотным. Пикнотическое ядро разрываться или лизируется. Примерно через 6 часов после того, как клетка подверглась повреждения активными формами кислорода, цитоплазма ее становится гомогенной. Разрушаются цитоплазматические белки и рибосомы. Набухание митохондрий и деструкция мембран органелл вызывают вакуолизацию цитоплазмы. Наконец, клетка переваривается собственными ферментами, которые высвобождаются из лизосом и лизируется (аутолиз). Литические ферменты распространяются на соседние клетки и межклеточный матрикс. Изменения межклеточного вещества при некрозе охватывают как межуточное вещество, так и волокнистые структуры. Межуточное вещество вследствие деполимеризации его гликозаминогликанов и пропитывания белками плазмы крови набухает и расплавляется. Коллагеновые волокна также набухают, пропитываются белками плазмы (фибрин), превращаются в плотные гомогенные массы, распадаются или лизируются. Изменения эластических волокон подобны описанным выше: набухание, базофилия, распад, расплавление - эластолиз. Ретикулярные волокна нередко сохраняются в очагах некроза длительное время, но затем подвергаются фрагментации и глыбчатому распаду. Распад волокнистых структур связан с активацией специфических ферментов -коллагеназы и эластазы. Присоединяется эффект эйкосаноидив, продуктов распада арахидоновой кислоты (простагландины тромбоксаны), которые увеличивают проницаемость мембраны и имеют выраженной бронхо- и вазомоторный активностью. Они вызывают бронхиолоспазм, спазм легочных вен и усиливают тромбообразование. Нейрофилы мигрируют в очаг повреждения и играют роль ручной гранаты, одноразового использования, которые обязательно погибают при фагоцитозе, синтезируя Активные формы кислорода. Агрегация и дегрануляция нейтрофилов сочетается с активацией комплемента и выходом хемотаксических анафилатоксинов С3 и С5. При таком массивном ударе биологически активных веществ по альвеолокапиллярной мембране она резко утолщается, а следовательно, диффузия газов через нее нарушается. Мембрана пропускает внутрь альвеолы плазменные белки, например фибриноген, которые уменьшают продукцию сурфактанта и без того угнетенную в связи с недоношенностью и ишемией. Растяжимость легких резко снижается, они становятся жесткими, формируются микроателектазы, возникает значительная гипоповентиляция, и шунтирование крови. В результате чего артериальная гипоксемия не поддается коррекции даже высоким давлением кислорода в дыхательных путях. При благоприятном исходе фазы альтерации и экссудации сменяются продуктивным воспалением с исходом в фиброзирование и репарацию легочной ткани. Гипоксия. Недостаток кислорода является физиологичным для плода, поэтому новорожденный ребенок имеет достаточно зрелые механизмы адаптации к гипоксии. Резкое снижение доставки кислорода в результате асфиксии, респираторного дистресс-синдрома, шока в условиях острой ишемии приводит к ряду регуляторных функционально-метаболических изменений в митохондриях вызывающих подавление аэробного синтеза энергии. При гипоксии в клетке включаются каскадные механизмы внутриклеточной сигнальной трансдукции, ответственные за экспрессию генов и формирования адаптивных признаков: активация протеинкиназы, открытие кальциевых каналов, усиление связанного с ним АТФ-зависимого транспорта кальция и повышенная генерация Н2О2. Такая активация проявляется уже через 2-5 минут кислородного голодания и протекает на фоне снижения дыхания. Более длительное пребывание в условиях пониженного содержания кислорода сопровождается переходом на новый уровень регулирования кислородного гомеостаза, характеризующийся экономизацией энергетического обмена и экспрессией индуцированных гипоксией генов позднего действия. В клетке накапливается значительная концентрация АФК, активизируются процессы ее апоптической гибели. Независимо от триггера БЛД в первые три дня жизни развивается первичный респираторный дистресс-синдром, с поражением всех трех слоев альвеол-капиллярной мембраны - эндотелия, интерстиция и альвеолярного слоя. При ингаляции высоких доз кислорода, мекониальний аспирации, инфекции, волюмо- и баротравме поражение начинается с альвеолярного слоя. И, наоборот, при асфиксии, шоковых, септических состояниях, массивной инфузии в раннем неонатальном периоде первым повреждается эндотелиальный слой. Таким образом, существуют разнообразные механизмы запуска развития БЛД у новорожденных. | |
|
| |
| Всего комментариев: 0 | |