13:53 Этапное лечение и диспансеризация больных рецидивирующим герпесом | |
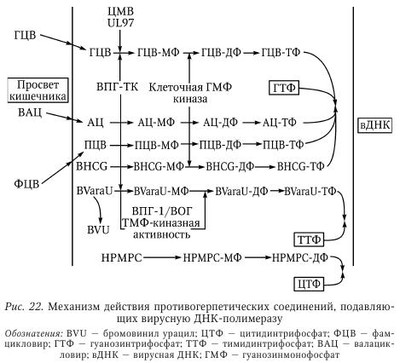
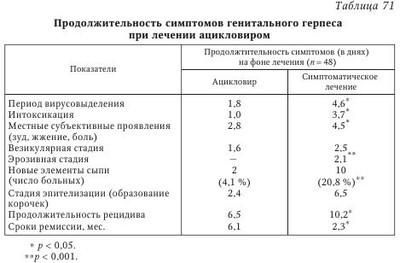
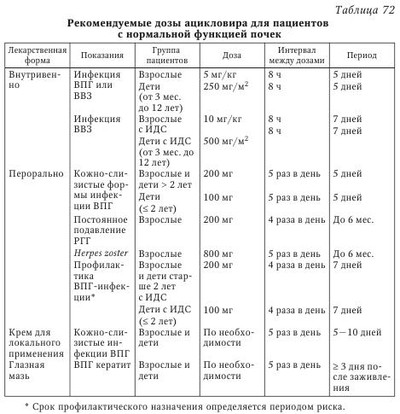
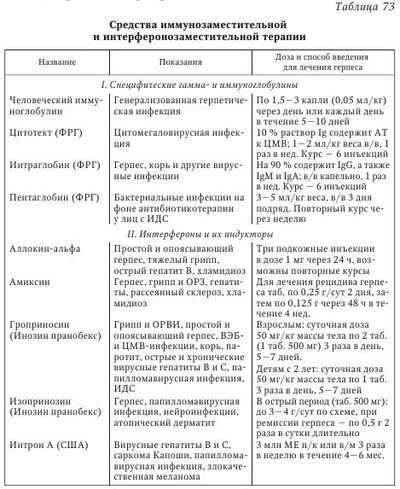
Лечение больных рецидивирующим герпесом (РГ) представляет определенные трудности как из-за отсутствия четкого понимания отдельных механизмов заболевания, часто рецидивирующего течения, так и в связи с отсутствием высокоэффективных и доступных противогерпетических химиопрепаратов (ХП) в сети практического здравоохранения. В терапии больных РГ мы придаем большое значение выработке тактики ведения пациента, установлению хорошего психологического климата во взаимоотношениях больного и врача, подбору оптимальных лекарственных форм и схем лечения, последующему диспансерному наблюдению. Доверительные отношения с пациентом, страдающим рецидивирующим генитальным герпесом (РГГ), особенно важны, ибо у 30—50 % больных РГГ имеются различные нарушения со стороны психоэмоциональной сферы. Так, S. М. Bierman при анализе поздних психологических реакций у больных РГГ показал, что депрессия беспокоила 50 % больных, ограничение контактов — 53 %, снижение либидо — 35 %, сексуальная абстиненция — 10 %, пониженная работоспособность — 40 %, и суицидальные мысли были отмечены у 10 % обследованных лиц. К сожалению, часть больных РГГ реализуют на практике свои суицидальные наклонности. Поэтому мы считаем обоснованным консультирование пациентов с РГГ специалистами различного профиля: психологами, гинекологами, сексопатологами, психотерапевтами, дерматовенерологами, инфекционистами, иммунологами и др. Открытые с помощью методов молекулярной биологии механизмы репликации ВПГ, а также изучение взаимодействия герпесвирусов с чувствительными клетками позволили за последние 40 лет создать целый ряд эффективных химиотерапевтических средств, обладающих противогерпетической активностью. Клинический опыт их применения показал, что, быстро и эффективно купируя острые проявления ГИ, противогерпетические средства не предотвращают повторного рецидивирования хронической ГИ, а в ряде случаев даже не снижают частоту рецидивов. Учитывая, что при герпесе, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы, для повышения эффективности проводимого лечения в схемы терапии необходимо включать иммунобиологические препараты и патогенетические средства. Они способствуют коррекции иммунологического статуса больного, облегчают состояние пациента, а также помогают более эффективному действию вышеперечисленных лекарств. Ho даже при применении современных схем комплексной терапии острых проявлений ГГ не всегда удается избежать повторного рецидивирования заболевания, а в ряде случаев добиться нормализации иммунологических показателей у больных. В связи с этим необходимо продолжить лечение в межрецидивный период с целью закрепления полученного терапевтического эффекта, коррекции остаточных иммунологических нарушений и создания благоприятных условий для проведения заключительного этапа лечения, дающего выраженный противорецидивный эффект, каким является применение герпетической вакцины. Иными словами, больные РГГ требуют лечения как в остром периоде (рецидив), так и в периоде реконвалесценции и в межрецидивном (ремиссия) периоде болезни. Вышеизложенные общие принципы терапии предопределяют комплексный системный подход к лечению ГГ, причем в случае рецидивирующего герпеса необходимым условием является проведение терапии в четыре взаимосвязанных между собой этапа. Длительность, интенсивность и объем терапевтических вмешательств определяются клинической формой заболевания и тяжестью его течения, а также периодом болезни, возрастом, наличием осложнений и сопутствующей патологии. I этап — лечение в острый период болезни (рецидив): 1. Базовая терапия — противогерпетические препараты (внутривенно, перорально, местно): ацикловир (АЦ), ацикловиры второго поколения (валацикловир, фамцикловир и др.). Менее активны бромуридин, бонафтон, теброфеновая или флореналевая мазь. Используют препараты растительного происхождения (флакозид, хелепин, алпизарин). Курс лечения рецидива ГИ обычно составляет 5—10 дней (табл. 70). Обязательное увеличение дозы химиопрепарата (в 2 раза по сравнению с назначением лицам с нормальной иммунной системой), продолжительности курса лечения и профилактики (недели, месяцы) у лиц с ИДС. 2. Антивирусные (этиотропные) ХП с различным механизмом действия применяются в сочетании с иммунобиологическими средствами: препараты ИФН или его индукторы, иммуномодуляторы. 3. Природные антиоксиданты (витамины E и С), курс 10—14 дней. 4. В случае выраженного экссудативного компонента показаны ингибиторы простагландинов (индометацин и др.), курс 10—14 дней. Коррекция ферментативных нарушений, восстановление нормальной микрофлоры кишечника (системная энзимотерапия, про- или пребиотики). Создание АЦ и его внедрение в практическое здравоохранение относятся к важнейшим достижениям современной химиотерапии герпесвирусных инфекций. Учитывая широкое поступление АЦ на отечественный рынок, целесообразно более подробно остановиться на оценке его терапевтической эффективности. Более 30 лет АЦ применяется в лечении больных ГИ. За это время в мире этим препаратом пролечено свыше 50 млн человек. Наш коллектив за последние 20 лет накопил большой опыт применения АЦ при лечении более 1000 больных различными формами ГИ, в том числе ГГ. АЦ обладает выраженным противогерпетическим действием, быстро купирует основные клинические проявления РГГ у больных, что способствует наступлению ремиссии. Химическая структура АЦ представляет собой ациклический аналог дезоксигуанозина, природного компонента ДНК, где кольцевая структура сахара замещена ациклической боковой цепью. В результате такой модификации вирусная ДНК-полимераза воспринимает его в качестве субстрата для производства вирусной ДНК. Являясь аналогом дезоксигуанозина, АЦ, подобно другим нуклеозидным аналогам, должен фосфорилироваться, прежде чем станет активным. Фосфорилирование, в результате которого образуется ацикловиртрифосфат (АЦ-ТФ) — конечный продукт, нарушающий синтез в ДНК, происходит в три этапа с образованием последовательно моно-, ди- и ацикловиртрифосфата. Основной, первый, этап фосфорилирования АЦ происходит под воздействием специфического фермента ВПГ — тимидинкиназы, причем этот процесс не наблюдается в сколько-нибудь заметной степени в неинфицированной клетке. В результате ошибки вирусной ДНК-полимеразы АЦ-ТФ встраивается в вирусную ДНК и прерывает синтез вирусной ДНК, блокируя репликацию вирусных частиц (рис. 22). Нуклеозиды дифосфат (ДФ) и трифосфат (ТФ) в составе антивирусных соединений специфичны к вирусным ДНК-полимеразам. ЦМВ не синтезирует вирусную тимидинкиназу, однако открытая рамка считывания UL97 кодирует пептид с киназоподобной активностью, благодаря чему он способен проводить первую стадию фосфорилирования ганцикловира (ГЦВ). В свою очередь, ацикловир (АЦ), пенцикловир (ПЦВ), лобукавир (BHCG) и соривудин (BVaraU) активируются специфическими ВПГ-ТК. Механизм фосфорилиро-вания лобукавира и соривудина охарактеризован недостаточно. Соривудин последовательно подвергается двум реакциям фосфорилирования, осуществляемым благодаря тимидилат-киназной активности ТК-пептидов ВПГ-1 или ВОГ. Цидофовир (HPMPC) является нуклеотидом, которому не требуется присутствие вирусной TK. Таким образом, два ключевых свойства — высокая избирательность и низкая токсичность по отношению к клеткам организма человека — обеспечили ацикловиру беспрецедентный успех среди всех остальных противогерпетических препаратов и позволяют считать его препаратом первого ряда при лечении ГИ. Однако чувствительность к АЦ различных герпесвирусов не одинакова. В порядке убывающей чувствительности к АЦ они располагаются следующим образом: ВПГ-1, ВПГ-2, ВВО-ОГ, ВЭБ и ЦМВ, ВГЧ-6 и ВГЧ-7. У последних отмечается недостаток вирусспецифической тимидинкиназы (TK), что требует для их подавления более высоких концентраций АЦ. Показано, что АЦ активнее цитарабина в 20 раз, идоксиуриди-на — в 100 раз, а видарабина — в 160 раз. Ацикловир применяется местно, внутрь и парентерально, причем он был первым противогерпетическим препаратом, который удалось создать для приема внутрь. Следует отметить, что не существует общепринятой классификации противогерпетических средств. Их можно группировать по химической основе, точке приложения или механизму действия. До появления специфически действующих аномальных нуклеотидов в терапии ГИ чаще всего использовали сочетания специфических ингибиторов синтеза вирусной ДНК с неспецифическими иммуномодуляторами или противогерпетическими вакцинами (см. табл. 70). В настоящее время в терапии ГИ приоритетное значение получили аномальные нуклеотиды, в частности АЦ, который стал последующей моделью для создания серии других синтетических противогерпетических препаратов (ганцикловир, фоскарнет, валацикловир, фамцикловир и пр.). В то же время врач должен помнить о недостатках, присущих всей группе ациклических нуклеозидов: препараты подавляют только активную репликацию TB. Поэтому разовое (курсовое) применение препаратов этой группы не предотвращает развитие рецидивов болезни, инфицирование родственным или новым типом ГВ и не влияет на показатели иммунитета. Тактика врага при легении рецидивирующего генитального герпеса сводится к следующему. Лечение РГГ не должно быть однонаправленным. В настоящее время предлагается две стратегии лечения РГГ: 1. Эпизодическое лечение обострений, для чего используют АЦ в дозе по 200 мг 5 раз в день в течение 5—10 дней подряд. При тяжелом герпесе либо течении основного заболевания у лиц со сниженным иммунитетом дозировку необходимо увеличить вдвое. Раннее начало применения АЦ дает наиболее быстрый терапевтический эффект. 2. Длительная (от 6 мес. до 1 года) непрерывная супрессивная терапия. После купирования острых явлений РГГ назначают АЦ в дозе по 400 мг 2 раза в день либо по 200 мг 4 раза в день в течение нескольких месяцев. Такая длительная непрерывная супрессивная терапия АЦ особенно показана больным, у которых заболевание часто рецидивирует (6 и более рецидивов в год), протекает тяжело или приводит к изменению в психике (при менструальном герпесе). При снижении общей дозы и частоты приема промежутки времени до возникновения рецидивов уменьшались. В то же время следует отметить, что терапевтические дозы противовирусных препаратов и продолжительность лечения четко не определены. Считается, что дозы и продолжительность лечения первичного эпизода ГГ и первого эпизода непервичного ГГ должны быть в два раза больше, чем при лечении рецидивов, когда длительность лечения зависит от скорости регрессии клинических признаков рецидива. Больным с частотой рецидивирования более 6 в год целесообразно назначать супрессивные схемы противовирусных препаратов. Стандартной дозой для АЦ при длительном применении считается доза 800 мг/сут (по 400 мг 2 раза в день). Преимущество валацикловира (ВАЦ) состоит в возможности его эффективного применения только один раз в день по 500 мг. Фамцикловир (ФЦВ), несмотря на его фармакокинетические преимущества перед первыми двумя препаратами, неэффективен при кратности его применения менее 2 раз в сутки. Продолжительность супрессивной терапии не определена. Результаты многочисленных исследований показали, что АЦ эффективен и хорошо переносится при супрессивной терапии, продолжающейся в течение 5 лет. В течение любого квартала пятого года лечения АЦ процент больных без рецидивов колебался от 85 до 90 %. Более чем у 20 % больных в течение всех пяти лет лечения вообще не было обострений. Начиная работать с пациентом, врач обязан рассказать ему о провоцирующих факторах, чтобы затем больной попытался установить, какие факторы способствуют обострению болезни. Необходимо рассказать пациенту о начальных признаках РГГ, чтобы он мог сразу (рано!) начать применение АЦ. Это может существенно сократить продолжительность рецидива и даже помочь избежать фазы образования эрозий. Затем больного РГГ учат оказывать себе симптоматическую терапию (прием анальгетиков), рассказывают о гигиене половых органов и необходимости воздержания от половых контактов во время болезни и лечения. В период появления предвестников обострения РГГ 16 больных начали принимать АЦ, в результате чего удалось нивелировать стадию образования эрозий, что является важным клиническим успехом. Наряду с клиническим улучшением нормализовались основные иммунологические показатели. Таким образом, рано начатое лечение АЦ способствовало быстрому наступлению клинико-иммунологической ремиссии. Возникновение резистентных штаммов ВПГ к АЦ у леченых больных с ненарушенным иммунитетом встречается крайне редко (у 2—5 %) и клинически несущественно. Причем устойчивые к АЦ штаммы вируса герпеса чаще выделяются у больных с герпетическими пневмониями, энцефалитами, кожно-слизистой формой ГИ на фоне выраженного иммунодефицита (5—10 % случаев). Однако до настоящего времени нет данных, подтверждающих, что штаммы ВПГ с дефицитом тимидинкиназы способны реактивироваться из латентного состояния и вызывать рецидив заболевания или трансформироваться в другие формы вируса. На наш взгляд, тестирование клинических изолятов ВПГ на чувствительность к ХП является необходимым звеном индивидуальной тактики ведения больных ГИ, особенно в тех случаях, когда имеет место тяжелое течение заболевания, а терапия носит неэффективный характер. Терапевтическая эффективность АЦ оценена нами при лечении 96 женщин и мужчин с РГГ в возрасте от 18 до 45 лет. Продолжительность болезни — от 2 до 5 лет, частота рецидивов — 4—8 в год. Ацикловир назначался по 200 мг 5 раз в день на 5—10 дней с учетом клинических проявлений. Оценка эффективности лечения АЦ производилась на основании анализа сроков везикуляции и времени эпителизации элементов сыпи, уменьшения площади поражения, а также уменьшения или исчезновения симптомов интоксикации. Учитывалось увеличение продолжительности межрецидивного периода не менее, чем в 1,5—2 раза. По сравнению с симптоматическим лечением (CЛ) терапия АЦ оказалась эффективной. Так, на фоне АЦ длительность периода высыпаний и общеинтоксикационного синдрома была меньше (р < 0,05), чем в случае применения CЛ. Время везикуляции, эпителизации было также достоверно короче при лечении АЦ, чем у больных, леченных симптоматическими средствами. Важно отметить, что на фоне терапии АЦ отсутствовала стадия эрозий, что существенно облегчает клиническое течение рецидива. Продолжительность межрецидивного периода в группе лиц, леченных АЦ, составила 6,1 мес. и леченных CЛ — 2,3 мес. (табл. 71). Углубленный анализ результатов применения АЦ при лечении ПГ показал, что время везикуляции сократилось у 88,46 % больных, что на 65,3 % больше, чем данный показатель при CЛ. Эпителизация элементов сыпи произошла быстрее у 84,6 % леченных АЦ больных (на 30,7 % больше, чем при CЛ). Площадь поражения уменьшилась у всех пациентов на фоне лечения АЦ, тогда как при CЛ это отмечено лишь в 30,7 % случаев. Уменьшение или исчезновение общеинфекционного синдрома наблюдалось в 2 раза чаще при лечении АЦ (92,1 %), чем при CЛ (46,1 %). После курса АЦ продолжительность ремиссии увеличивалась в 6 раз чаще, чем без его применения (у 76,9 и 15,3 % соответственно). Полученные результаты свидетельствуют о высокой терапевтической эффективности АЦ по сравнению с симптоматическими средствами (р < 0,01—0,001). До и после лечения АЦ проводили иммунологическое обследование больных, которое включало определение субпопуляций Т-лимфоцитов и число В-лимфоцитов в периферической крови, индекса дифференцирования Т-лимфоцитов, значения РТМЛ с фитогемагглютинином (ФГА), содержания сывороточных иммуноглобулинов классов А, М, G и СЗ компонента комплемента. Отмечено повышение содержания субпопуляции Т-хелперов после лечения АЦ (20 и 32 % соответственно). Менее выраженными стали показатели PTMЛ с ФГА (79 и 63 % соответственно), снизилось содержание сывороточных IgA (3,0 и 1,95 г/л соответственно). Остальные показатели иммунитета оставались практически без изменений. Таким образом, лечение АЦ (монопрепарат) больных рецидивирующей ГИ способствовало наступлению клинической ремиссии без существенных изменений иммунного гомеостаза. Следует отметить, что АЦ проявляет разную терапевтическую активность в отношении всего семейства TB, однако наилучший терапевтический эффект отмечен при лечении простого и опоясывающего герпеса. Рекомендуемые дозы АЦ для пациентов с нормальной функцией почек показаны в табл. 72. Рецидивирующие вирусные инфекции сопровождаются развитием дисбаланса различных звеньев иммунной системы. Это является одной из причин длительной персистенции вирусов, поражения различных органов и систем. В комплексной терапии таких больных наряду с противовирусными средствами используются препараты ИФН и индукторы ИФН, иммуномодуляторы, препараты системной энзимотерапии (СЭТ), другие патогенетические средства (табл. 73). II этап — терапия в фазе ремиссии, после стихания основных клинических проявлений герпетической инфекции (фаза эпителизации, после отпадения корочек). Это ранняя реконвалесценция, 8—15-й дни рецидивов. Основная цель в этом периоде — достижение клинико-иммунологической ремиссии, подготовка больного к вакцинотерапии. Показано соблюдение режима труда и отдыха, диета должна быть разнообразной, богатой витаминами и микроэлементами. Учитывая нарушения различных звеньев иммунитета, которые сохраняются у пациентов с ГГ и в фазе ремиссии, показано применение иммуномодуляторов (возможно тех же, что и в периоде рецидива) или адаптогенов растительного происхождения, например из семейства аралиевых, препаратов золотого корня, лимонника, аира, витамедина-М и др. При выраженной иммуносупрессии показано назначение препаратов тимуса коротким курсом. Продолжить применение средств с иммуномодулирующим эффектом (интерферонов и его индукторов), коррекция ферментативных нарушений, восстановление нормальной микрофлоры кишечника (системная энзимотерапия, про- или пребиотики). Проводится симптоматическое, общеукрепляющее, физиотерапевтическое лечение, санация очагов инфекции, терапия хронических воспалительных заболеваний. Считают, что рецидивирующие формы герпеса встречаются у 2—6 % населения, генитальным герпесом страдают 0,5—2,0 %, а в развитых странах — до 6—10 % взрослого населения. У больных с онкологической патологией ГИ встречается в 50 % случаев, а при ВИЧ-инфекции — в 60—100 % случаев. Таким образом, ГИ является серьезной проблемой для больных с иммунодефицитными состояниями. III этап — специфическая профилактика рецидивов ГИ с использованием герпетических вакцин — инактивированных («Витагерпавак»), рекомбинантных (через 1—2 мес. после окончания рецидива). Цель вакцинации — активация клеточного иммунного ответа, его иммунокоррекция и специфическая десенсибилизация организма. Следует отметить, что этот этап чаще наступает не ранее 1—2 мес. после окончания фазы обострения ГГ, при наличии клинико-иммунологической ремиссии заболевания. В России с целью профилактики рецидивов ГИ, в том числе ГГ, в фазе клинико-иммунологической ремиссии используют отечественные противогерпетические культуральные инактивированные вакцины «Герповакс» (Санкт-Петербург) и «Витагерпавак» (Москва). Известно, что иммунодефицит у больных РГГ в фазе ремиссии может длительно сохраняться, в том числе остается низким титр сывороточных интерферонов, снижена продукция ИФН лейкоцитами. В связи с этим появились сообщения, в которых рекомендуют специфическую вакцинацию проводить на фоне использования препаратов ИФН, в частности реаферона, что позволяет пролонгировать фазу ремиссии. Применяются и другие препараты ИФН и его индукторы (циклоферон) совместно с противогерпетическими вакцинами (см. в главе 12). Показано, что у 30—50 % больных первичным герпесом в течение 2—3 лет отмечаются рецидивы заболевания, которые возникают после провоцирующих факторов (охлаждения, избыточной инсоляции и т. д.) и не предотвращаются многомесячным применением противогерпетических ХП (ацикловира др.). В таких случаях специфическая вакцинация способна значительно снизить риск развития рецидива заболевания и служит для его профилактики. IV этап — диспансерное наблюдение и реабилитация больных ГИ. Система этапного лечения больных РГГ предусматривает диспансерное наблюдение и плановое клинико-лабораторное обследование пациентов в фазе ремиссии (1 раз в 3—6 мес.), а также в период обострения болезни. Врачам рекомендуется: 1. Проводить активное наблюдение с клинико-лабораторным мониторингом (вирусологическое и иммунологическое обследование больных), санация хронических очагов инфекции, иммунореабилитация. Для консультаций привлекаются необходимые специалисты. 2. Проводить симптоматическую (патогенетическую) терапию с учетом состояния пациента (системная энзимотерапия, пребиотики, иммуномодуляторы и т. д.). 3. Повторное использование вакцины с целью профилактики рецидивов ГВИ. В стратегическом плане разработанное и предложенное нами 20 лет назад этапное лечение и диспансерное наблюдение больных рецидивирующим герпесом выдержало испытание временем и поддержано практикующими врачами и учеными. Так, М. В. Мокеева наблюдала 103 больных РГГ в возрасте от 21 до 50 лет обоего пола, а также 110 соматически здоровых лиц. Больные ГИ имели легкое, среднетяжелое и тяжелое течение болезни с частотой рецидивов от 3 до 8 и более раз в году. Установлено, что с возрастом у женщин тяжесть клинических проявлений РГГ возрастает, тогда как у мужчин отмечается лишь более выраженный астенический синдром. Автор предложила объективизировать оценку степени тяжести РГГ по сумме клинических (местных и общих) признаков, выраженных в баллах. Так, легкая форма РГГ была при наличии признаков, оцененных до 8 баллов, среднетяжелая — при 8,5—12 баллах, тяжелая — свыше 12,5 баллов. Показано, что при легком течении РГГ клеточный иммунодефицит встречается в 56 % случаев, при среднетяжелом течении — в 85,1 %, у тяжелых больных — в 100 % случаев. Комплексная этапная терапия РГГ проводилась дифференцированно с учетом степени тяжести клинико-иммунологических проявлений генитального герпеса и периода болезни, при этом использовались новые противовирусные (валтрекс) и иммунотропные (полиоксидоний, неовир, циклоферон) препараты в оригинальном сочетании. Показано положительное влияние предложенного комплексного этапного лечения на клиническое течение рецидивов у мужчин и женщин. В результате данной терапии достоверно уменьшилось количество больных с тяжелым течением РГГ (с 29,1 до 9,7 %), отмечена положительная динамика показателей клеточного и гуморального звеньев иммунитета, элиминационные механизмы не отреагировали на комплексную терапию. Показаны отчетливые клинико-иммунологические преимущества комплексной этапной терапии РГГ по сравнению с монотерапией ацикловиром отдельных рецидивов болезни. Проанализированы отдаленные результаты лечения во время клинико-иммунологического обследования 35 больных через 3 года и 18 пациентов — через 6 лет после окончания комплексной этапной терапии. Показана возможность стабилизации клинического состояния и сохранения позитивных изменений в иммунограмме (Т-клеточное звено иммунитета), снижение содержания иммуноглобулинов класса G к ВПГ и ЦМВ под влиянием терапии. Изменения показателей элиминационных механизмов выявлено не было. В заключение еще раз делается важный вывод о целесообразности и большей эффективности комплексной этапной терапии РГГ по сравнению с монотерапией ацикловиром только во время рецидивов ГГ. | |
|
| |
| Всего комментариев: 0 | |