13:19 Герпес у онкогематологических больных | |
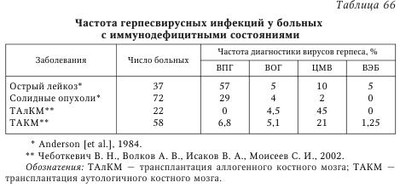
Клиническое течение ВПГ- и ЦМВ-инфекций во многом определяется особенностями поражения иммунной системы при различных нозологических формах. Иммунодефицит при лейкозах обусловлен как поражением кроветворных клеток, так и проводимой противоопухолевой химиотерапией, воздействующей не только на опухолевый клон, но и на интактные иммунокомпетентные клетки. В структуре инфекционных осложнений у больных лейкозами, особенно при трансплантации костного мозга (TKM), значительную роль играют герпесвирусы, которые вызывают тяжелые осложнения у онкогематологических больных. Особую актуальность ЦМВ-инфекция имеет у больных лейкозами, подвергнутых TKM, у лиц, получающих многократные инфузии крови и ее препаратов (табл. 66). У иммунокомпетентных лиц контакт с ЦМВ-инфекцией протекает бессимптомно, но при ослаблении иммунитета болезнь приобретает клинически выраженный характер. По данным американских исследователей, более 60 % людей старше 35 лет имеют комплемент-связывающие антитела к ЦМВ, т. е. они имели контакт с ЦМВ и могут быть потенциальными его носителями. Также особый интерес представляет проблема ЦМВ-осложнений при TKM у онкогематологических больных. Установлено, что у половины всех больных, подвергнутых ТКМ, наблюдается ЦМВ-инфекция различной степени тяжести. Клинические проявления ЦМВ-болезни у реципиентов органов и тканей возникают преимущественно не в период индукции гемоиммунодепрессии (до трансплантации), а в первые 3—16 нед. после трансплантации. Это говорит о связи активации ЦМВ у реципиентов со сложными иммунологическими взаимоотношениями организма больного и пересаженного органа. При TKM у больных гемобластозами летальность от цитомегаловирусной пневмонии может достигать 80 % даже в ведущих гематологических клиниках. ЦМВ играет главную роль в развитии вирусных осложнений у больных с ТКМ, поэтому он привлекает наибольшее внимание как гематологов, так и вирусологов и иммунологов. Герпесвирусная инфекция, в частности ВПГ-2, может выступать (возможно, в ассоциации с ЦМВ, хламидиями и микоплазмами) и в качестве индуктора развития дисплазии и поддержания ее в состоянии стабилизации. Особенно тщательно должны обследоваться и наблюдаться женщины, у которых определяются признаки инфицированности ВПГ-2 в сочетании с ВПЧ. Такие пациентки имеют повышенный риск возникновения рака шейки матки. Вирус Эпстайна — Барр способен вызывать лимфому Беркитта и назофарингеальную карциному. Многочисленные ГВ животных также вызывают у своих хозяев онкологические заболевания: саркомы, лимфомы и аденокарциномы. При СПИДе цитомегаловирус (ЦМВ) часто поражает орган зрения, а у иммунодефицитных онкогематологических больных наибольшей проблемой является патология органов дыхания. Неясен также вопрос, действительно ли TB играют монопольную роль в возникновении инфекционных осложнений или болезнь развивается при участии других инфекционных агентов, в частности респираторных вирусов. Вирусные инфекции сопровождаются снижением защитных механизмов иммунной системы с первичным инфицированием вирусами или их реактивацией. У больных опухолями лимфатической системы (ОЛС) в патологический процесс непосредственно вовлечены клетки иммунной системы, поэтому важно было установить взаимосвязь степени выраженности вторичной иммунной недостаточности с активацией вирусной инфекции. Методом ПЦР обследована кровь 78 пациентов и выделена группа вирусинфицированных больных, которая составила 23 человека (29,5 %). Распределение маркеров вирусной инфекции: ВГВ — 6 пациентов (23,1 %), ВГС — 8 (30,8 %), ЦМВ — 7 (26,9 %), ВПГ-1/2 — 4 (15,4 %), ВЭБ — 1 (3,8 %). При этом у 3 пациентов было обнаружено сочетание инфекционных маркеров: ЦМВ и ВПГ, ВГС и ВЭБ, ВГВ и ВПГ. Иммунологическое обследование включало определение концентрации сывороточных иммуноглобулинов (IgG, IgM, IgA), показателей функциональной активности нейтрофилов, субпопуляционный состав лимфоцитов, а также показателей спонтанной и стимулированной продукции цитокинов мононуклеарами крови. (Статистический анализ выполнен с использованием программы STATISTICA 6.0.) Данные представлены в виде медиан и квартилей. Достоверность различий показателей подтверждалась расчетом критерия Манна — Уитни. Полученные результаты не выявили достоверных различий в содержании сывороточных иммуноглобулинов и активности нейтрофилов в НСТ-тесте в группах вирусинфицированных и вируснегативных больных. Исследование количественного состава иммунокомпетентных клеток выявило достоверно более низкое значение показателя CD16+ лимфоцитов в группе пациентов с вирусной контаминацией — 18,4 % (12,0 %; 22,4 %) по сравнению с вируснегативными больными — 20,3 % (16,3 %; 25,6 %, р < 0,05). В то же время число CD3+, CD4+, CD8+, CD25+, СD95+-лимфоцитов и значения иммунорегуляторного индекса не имели существенных различий в выделенных группах. Для определения связи числа СГ)16+-лимфоцитов с возможным обнаружением маркеров вирусной репликации у больных OЛC был рассчитан коэффициент корреляции Спирмена (Rs), который составил -0,23 (р < 0,05). Полученные данные свидетельствуют о том, что при уменьшении количества СD16+-клеток вероятность активации вирусной инфекции у больных OЛC возрастает. Выявлен достоверный рост спонтанного уровня ИЛ-1в у больных с маркерами вирусной инфекции — 509,0 пг/мл (306,3 пг/мл; 668.6 пг/мл) по сравнению с вируснегативными больными — 245.6 пг/мл (124,2 пг/мл; 403,6 пг/мл, р < 0,05). Статистически достоверного изменения содержания других цитокинов, вырабатываемых как спонтанно, так и после стимуляции фитогемагглютинином, не наблюдалось. Частота реактивации герпесвирусов при аллогенной трансплантации гемопоэтигеских стволовых клеток. Общеизвестно, что иммунодепрессивные состояния после трансплантации гемопоэтических стволовых клеток (ТГСК) сопровождаются реактивацией микробных и вирусных патогенов, что приводит к развитию инфекционных осложнений смешанного генеза. В связи с этим исследовали частоту реактивации латентных вирусов герпеса в организме больных на ранних сроках после ТГСК и поиск корреляций с типичными осложнениями в этот период. В Институте детской гематологии и трансплантологии им. Р. М. Горбачевой обследовано 143 больных с различными онкогематологическими заболеваниями, в том числе острый лимфолейкоз (n = 51), острый миелолейкоз (n = 37), хронический миелолейкоз (n = 15), лимфомы (n = 9), миелодепрессивный синдром (n = 6). Пациентам проводилась аллогенная ТГСК. Больным трансплантировали костный мозг (35 %) или периферические стволовые клетки (65 %). Неродственные ТГСК проводились в 64 % случаев. Детекцию ДНК ЦМВ, ВПГ и ВЭБ проводили в лейкоцитах периферической крови и костного мозга с помощью стандартизированного метода геноспецифической ПЦР («Интерлабсервис») еженедельно до 100 сут. после ТГСК. Оценивали выраженность острой реакции «трансплантат против хозяина» (РТПХ), регистрировали другие осложнения (пневмонии, неврологические нарушения, мукозиты, циститы). ВПГ, ЦМВ и ВЭБ выявлялись в клетках крови после ТГСК соответственно в 51 %, 57 % и 45 % случаев (в 2,3—2,5 раза чаще, чем до пересадки). Вид основного заболевания, пол и тип трансплантата не влияли на эти соотношения. В то же время частота выявления ВПГ и ЦМВ зависела от возраста больных, при минимальной частоте выявления в группе 1—4 г. и возрастанием к 10—20 г. Среди больных молодого возраста (менее 21 г.) была найдена корреляция между неврологическими симптомами и повторным выявлением ВПГ (р = 0,002). Кроме того, тяжесть мукозита связана с персистенцией ВПГ или ЦМВ (р = 0,02 или 0,008). Риск развития кишечной формы острой РТПХ и частота посттрансплантационного геморрагического цистита также коррелировали с активацией ВЭБ (р = 0,01). Таким образом, удалось проследить временную тенденцию реактивации герпесвирусов и постепенное снижение вирусного фона в течение раннего периода после ТГСК. Выявлено наличие ассоциаций между частотой обнаружения ВПГ, ВЭБ, ЦМВ и некоторыми общими осложнениями алло-ТГСК, что отражает общее снижение клеточного иммунитета у больных после ТГСК. Поэтому расширение спектра диагностируемых инфекционных патогенов (в частности, определение парвовируса В19, ряда патогенных грибов и др.) после ТГСК заслуживает дальнейшего изучения. Распространенность серологигеских маркеров герпесвирусов у больных хронигеским лимфолейкозом. Вирусные инфекции являются наиболее грозными осложнениями у гематологических больных, получающих лечение согласно современным программам химиотерапии. Среди возбудителей вирусных инфекций чрезвычайно важная роль отводится представителям семейства Herpesviridae. В работе изучена частота выявления серологических маркеров ВПГ-1 и ВПГ-2, ЦМВ, ВЭБ, ВВЗ, а также ВГЧ-6 и ВГЧ-8 у больных хроническим лимфолейкозом (XЛЛ), получавших лечение по программе RFC и с участием Campath-1. Было обследовано 52 образца сывороток больных XJIJI, преимущественно В-клеточной природы. Методом ИФА проводили выявление серологических маркеров ВПГ-1, ВПГ-2 (антитела класса IgG к ВПГ-1, ВПГ-2, суммарные антитела класса IgM), IgG-антитела к ВГЧ-6 и ВГЧ-8, антитела IgG и IgM к ВВЗ, а также IgG к гликопротеину E ВВЗ, антитела класса IgM и класса IgG к ядерному и капсидному антигенам ВЭБ, IgM и IgG антитела к ЦМВ с определением авидности последних. Частота острых стадий вирусных инфекций не превышала 10 % случаев, в частности: суммарные IgM-антитела к ВПГ обнаруживали в 7,7 % наблюдений: ВВЗ-IgM и ВВЗ-gE-IgG — в 9,6 % и 3,9 % случаев соответственно; IgM-антитела к капсидному антигену ВЭБ — у 5,8 % больных и CMV-IgM — у 7,7 % пациентов. При анализе полученных результатов обращалось внимание на отсутствие IgG-антител к ВГЧ-8 во всех исследуемых образцах. В 92,3 % наблюдений выявлены антитела класса IgG к ВГЧ-6, являющегося одним из факторов развития иммунодепрессии. Кроме того, у 98,1 % пациентов были выявлены IgG-антитела к ВПГ-1 и у 19,2 % — IgG к ВПГ-2. К ВВЗ антитела класса IgG наблюдались у 80,8 % больных. Серологические маркеры ВЭБ, в частности антитела к капсидному и ядерному антигенам, определялись в 36,5 % и 69,2 % случаев соответственно. Во всех исследуемых образцах присутствовали IgG-антитела к ЦМВ в средней концентрации 4,25 МЕ/мл с авидностью 86,9 %. Кроме того, было выделено 4 группы пациентов в зависимости от наличия антител к различным TB. В первую группу вошли 4 больных (7,7 %) с выявленными маркерами трех вирусов: в одном случае наблюдали антитела к ВПГ-1, ВВЗ и ЦМВ, в трех случаях — к ВПГ-1, ВГЧ-6 и ЦМВ. Вторую группу составили 16 человек (30,8 %) с антителами к четырем ГВ. Из них у 6 определялись маркеры ВПГ-1, ВГЧ-6, ВВЗ и ЦМВ; еще у 6 пациентов присутствовали признаки ВПГ-1, ВГЧ-6, ВЭБ и ЦМВ; у 3 - ВПГ-1, ВВЗ, ВЭБ и ЦМВ и в одном случае — ВГЧ-6, ВВЗ, ВЭБ и ЦМВ. Самой многочисленной по числу наблюдений оказалась третья группа — 26 человек (50,0 %), где у каждого больного выделены маркеры пяти вирусов: у 1 пациента - к ВПГ-1, ВПГ-2, ВГЧ-6, ВЭБ и ЦМВ; у 3 - к ВПГ-1, ВПГ-2, ВГЧ-6, ВВЗ и ЦМВ и в 24 случаях - к ВПГ-1, ВГЧ-6, ВВЗ, ВЭБ и ЦМВ. В четвертую группу включены 6 пациентов с XЛЛ, у которых в сыворотке периферической крови были обнаружены антитела к ВПГ-1, ВПГ-2, ВГЧ-6, ВВЗ, ВЭБ и ЦМВ. Следовательно, в значительном числе наблюдений в сыворотке крови больных XЛЛ присутствовали маркеры ВПГ-1 типа, ВГЧ-6, ВВЗ и ЦМВ. Причем практически во всех случаях отмечались признаки инфицирования более чем тремя ГB. Учитывая, что течение гематологических заболеваний всегда сочетается с формированием иммунодефицитного состояния, которое усугубляется применением программ современной полихимиотерапии, а также значительную частоту выявления серологических маркеров герпесвирусных инфекций, больные XЛЛ входят в группу повышенного риска инфицирования и/или реактивации вирусов. Возникновение вирусных осложнений может негативно повлиять на эффективность базисной терапии, течение и исход основного заболевания. Таким образом, важным моментом терапии гематологических больных является динамический серологический контроль маркеров вирусных инфекций, который позволит при выявлении признаков острой фазы инфекции своевременно назначить противовирусные препараты. Динамика маркеров герпесвирусов у больных острыми лейкозами в период первого курса полихимиотерапии. Ранее было показано, что первый этап химиотерапии (XT) у больных острыми лейкозами (OЛ) осложняется активацией ГВ. Тихомиров Д. С. изучили динамику маркеров ГВ у больных ОЛ на первом этапе XT и ее влияние на активность ГВ в период индукции ремиссии у пациентов. Исследовали материалы от 48 больных, страдающих острыми лейкозами, в частности острым лимфобластным лейкозом (OЛЛ) — 13 человек, острым миелобластным лейкозом (OMЛ) — 35 человек, находящихся в отделении высокодозной химиотерапии гемобластозов и трансплантации костного мозга Гематологического научного центра РАМН. Материал (кровь, бронхоальвеолярный лаваж) обследовали в дни введения цитостатических химиопрепаратов. Методом ИФА определяли IgM- и IgG-антитела к ВПГ-1, ВПГ-2, ЦМВ, ВЭБ. Вирусспецифические ДНК определяли методом ПЦР. В дебюте ОЛ у подавляющего числа пациентов (38 из 48) были выявлены маркеры активации ВЭБ (ДНК и/или IgM-VCA/IgG-EA ВЭБ). В процессе лечения наблюдалось снижение частоты выявления ДНК ВЭБ: у больных ОЛЛ — на 28-й день, у больных ОМЛ — на 16-й день терапии. Перед вторым курсом XT, когда у подавляющего большинства пациентов констатирована клинико-гематологическая ремиссия, частота выявления лабораторных признаков активации ВЭБ составила 40 % (18 из 48), что статистически достоверно ниже, чем в дебюте (79,2 %, р = 0,0001). До лечения лейкоза у 4 больных были выявлены маркеры активации ВПГ-1/2 (ДНК и/или IgM-BПГ-1/2), у 8 пациентов — маркеры активной ЦМВ-инфекции (ДНК и/или IgM-ЦМВ). После индукционного курса XT частота обнаружения маркеров активации ЦМВ и ВПГ-1/2 составила 4 из 48 и 1 из 48 больных соответственно. Такая частота статистически не отличалась от частоты в дебюте заболевания (р = 0,419 и 0,398 соответственно). Также обнаружено, что с 21-го по 35-й дни у больных с ОЛЛ отмечались случаи выявления ДНК ВГЧ-6 типа. У большинства больных (46 из 48) на протяжении всего курса XT сохранялись высокие титры IgG-BПГ-1/2 (1 : 6400—1 : 12 800). Таим образом, в период дебюта ОЛ часто выявляли маркеры активной ВЭБ-инфекции. В процессе XT эта частота достоверно снижалась с 79 до 40 %. Частота выявления маркеров активной ЦМВ-и ВПГ-1/2-инфекцией находилась в пределах 10 % и достоверно не изменялась в ходе лечения. Высокие титры IgG-BПГ-1/2 на всем протяжении индукционной XT свидетельствуют о сохранности гуморального звена иммунитета у больных ОЛ. В работе Хоробрых М. Н. с соавт. дана характеристика вирусных осложнений у больных ХЛЛ на фоне терапии алемтузумабом (моноклональные анти-С052 антитела). В исследование включено 22 больных ХЛЛ от 42 до 72 лет (медиана — 59 лет). Среди них 11 больных получали монотерапию алемтузумабом по 30 мг 3 раза в неделю в течение 8—14 нед. и 11 пациентов лечились комбинированной терапией по программе FluCam — до 6 курсов (алемтузумаб 30 мг, флударабин 30 мг/м2 в течение 3 дней, каждые 28 дней). Профилактику ЦМВ-инфекции проводили ацикловиром 800 мг/сут (12 больных) и ванганцикловиром 900 мг/сут (10 больных). На фоне лечения алемтузумабом происходила реактивация ЦМВ у 64 % больных при применении препарата в монорежиме и в 2 раза реже (27 %) — у пациентов, которые лечились по программе FluCam. Использование ацикловира сопровождалось у 50 % пациентов реактивацией ЦМВ и клиническими проявлениями в виде длительной лихорадки с необходимостью назначения парентерально ганцикловира. В группе больных, получающих ванганцикловир, бессимптомная реактивация ЦМВ была лишь у 30 % больных. Анализ инфекционных осложнений у больных гемобластозами в Самарском регионе. Инфекционные осложнения могут быть фатальными при гемобластозах и, особенно, при депрессиях кроветворения, если не проводится эффективная антибактериальная терапия. Спектр микроорганизмов, ответственных за инфекционный процесс, периодически претерпевает изменения и может различаться как в отдельных регионах, так и в лечебных учреждениях. В связи с этим исследовали инфекционные осложнения у больных гемобластозами и депрессиями кроветворения в отделении гематологии Самарской областной клинической больницы для выработки тактики своевременной диагностики, эмпирической и направленной терапии инфекций. Проведено ретроспективное исследование 1117 историй болезни пациентов с острым лейкозом, находившихся на лечении в гематологическом отделении с 2006 по 2009 г. Из них инфекционные осложнения были выявлены у 113 больных (10,1 %), при этом состояние нейтропении было в 45 % случаев. В структуре инфекционных осложнений доминировали сепсис (49,6 %) и пневмонии (48,6 %), в 15 % случаев выявлено их сочетание. Некротическая энтеропатия диагностирована в 8,8 %, а мукозит/стоматит — в 3,5 % случаев. Катетер-ассоциированная инфекция была установлена у 1 больного (0,08 %). Почти в половине случаев пневмоний патологический процесс захватывал оба легких и носил полисегментарный характер (47,2 %). У троих больных пневмония сопровождалась синдромом диссеминации и была вызвана грибами (Pneumocystis carini, Candida spp.). Среди выявленных бактериальных патогенов чаще высевался Staphylococcus aureus (13,8 %), реже — представители грамотрицательной флоры — Klebsiella pneumoniae (11,1 %) и Pseudomonas aeruginosa (2,7 %). В общей структуре возбудителей сепсиса преобладали грамположительные бактерии (66 %) над грамотрицательной микрофлорой, которая выявлена в 40 % гемокультур. Следует отметить, что в 6 % случаев флора была смешанной. Грибы в крови выявлены у 7,5 % больных. В основном это были представители Candida non-albicans. Бактерии семейства Enterobacteriaceae выявлялись в 34 % случаев, среди которых в 21 % определялась Escherichia coli, а в 7,5 % случаев — Salmonella enteritidis. Неферментирующие бактерии были представлены Pseudomonas aeruginosa (4 %) и Stenotrophomonas maltophilia (2 %). В структуре грамположительных бактерий преобладал Staphylococcus coagulase-negative (38 %), Staphylococcus aureus (9 %) и Enterococcus faecium (9 %). Проведенный мониторинг гемокультур в гематологическом отделении показал, что Staphylococcus coagulase-negative выявлялся в 31 % случаев, а в структуре микрофлоры преобладали грамотрицательные патогены (62,1 %). Среди грамотрицательных бактерий доминировали Escherichia coli (20,7 %). Далее следовали Klebsiella pneumoniae (17,2 %), Pseudomonas aeruginosa (10,3 %). В двух случаях был высеян Acinetobacter. Таким образом, полученные данные могут быть использованы для разработки региональных стандартов своевременной диагностики и рациональной антимикробной терапии инфекционных осложнений у больных с гемобластозами. В.Н. Чеботкевич с соавт. изучил частоту ассоциаций ГВИ с респираторными вирусами и Mycoplasma pneumoniae. Было обследовано в динамике 60 больных различными формами лейкозов, у которых диагностирована ЦМВИ, и 40 больных с ГВИ, вызванной ВПГ-1, ВПГ-2 типов. Из указанного количества больных 26 были подвергнуты ТАлКМ, 47 — TAKM и 27 больных получали курс интенсивной противоопухолевой химиотерапии (ИПХТ). Материал для исследования (кровь, смывы из носа) получали от больных с интервалами 10—12 дней в течение 2—6 мес. Всего у 60 больных с различными формами лейкозов было диагностировано 24 эпизода ЦМВИ. Самым частым ассоциантом (7 случаев) оказался респираторно-синцитиальный (PC) вирус, причем он был выявлен только в группе ТАлКМ у 7 из 10 больных с выявленной ЦМВИ. Важно отметить, что в 7 выявленных случаях он выступал в ассоциации с другими респираторными вирусами и М. pneumoniae. В двух случаях наблюдалась смешанная инфекция PC-вируса с аденовирусами, причем в одном из них также в ассоциации с коронавирусами. У одного больного были ассоциации с коронавирусами и по два случая ассоциаций с вирусами парагриппа и М. pneumoniae. У двух больных развитию ЦМВИ предшествовала коронавирусная и М. pneumoniae инфекции. В целом ассоциированные ЦМВ-респираторно-вирусные и микоплазменные инфекции выявлены у 9 из 10 больных группы ТАлКМ (90 %). Характер ассоциаций ЦМВ у больных с TAKM был иным. Так, в этой группе ассоциированные инфекции выявлены у 6 из 12 больных с ЦМВИ (50 %). Причем только в одном случае в качестве ассоцианта выступали 2 респираторных вируса (адено- и коронавирусы). В двух случаях наблюдалась смешанная М. pneumoniae инфекция (в одном случае — с аденовирусами, в другом — с коронавирусами). В двух случаях развитию ЦМВИ предшествовало развитие корона-вирусной и М. pneumoniae инфекции. При высокодозной химиотерапии было выявлено развитие ЦМВИ только у двух из 15 обследованных больных. Причем у одного из них возникновению ЦМВИ предшествовала парагриппозная инфекция. Развитие ЦМВИ на фоне гриппа А не выявлено ни в одном случае. Полученные результаты позволяют предположить участие респираторных вирусов в патогенезе ЦМВИ у онкогематологических больных. Известно, что респираторные вирусы и М. pneumoniae обладают значительным иммунодепрессивным действием. Высокая частота этих инфекций у обследованных групп больных является дополнительным аргументом в пользу возможной активации латентной ЦМВИ на фоне респираторных и М. pneumoniae инфекций у больных лейкозами. Далее авторы проанализировали особенности развития смешанных герпетических и респираторных вирусных инфекций. Обусловленные ВПГ инфекции выявлены во всех обследованных группах больных, причем при TAKM не только после трансплантации, но и до нее. Как и при ЦМВИ, с высокой частотой были ассоциации ВПГ с респираторными вирусами и М. pneumoniae. В то же время характер такой ассоциации оказался несколько иным, чем рассмотренные выше ассоциации с ЦМВ. Установлено, что частота смешанных ГИ с респираторными вирусами при ТАлКМ составила 57,1 % (4 случая из 7), при TAKM — 80 % (4 случая из 5). У больных, получавших высокодозную химиотерапию, во всех трех случаях смешанных инфекций выявлен вирус гриппа А, у одного больного — в ассоциации с аденовирусами, у второго — с вирусами парагриппа, у третьего — с М. pneumoniae. В отличие от ЦМВИ при заболеваниях, обусловленных ВПГ, ассоциации с вирусом гриппа А встречались в 25 % случаев (у 4 из 16 больных с установленной ГВИ). Кроме того, особенностью респираторных вирусных инфекций на фоне ГИ явилось то, что они часто развивались на фоне ГИ, тогда как при ЦМВИ респираторные инфекции, как правило, предшествовали ее развитию. Представленнные материалы показывают, что респираторные вирусы и М. pneumoniae являются наиболее частыми возбудителями — ассоциантами с вирусами семейства герпеса — ЦМВ и ВПГ. Их участие, очевидно, в значительной степени определяет тяжесть инфекционного процесса. Иммуносупрессивный тип саркомы Капоши (ИССК) развивается у реципиентов трансплантата внутренних органов и у больных с тяжелыми заболеваниями, получавших иммуносупрессивную терапию. Соотношение мужчин и женщин при этом типе CK оценивается как 2:1, тогда как при идиопатической CK — как 17 : 1, при СПИД-ассоциированной CK — как 50 : 1 и 100 : 1. В общей структуре новообразований у реципиентов почечного трансплантата на долю CK приходится 3,5 %. ИССК вначале характеризуется локализованными высыпаниями. Вскоре они стремительно прогрессируют, увеличиваясь в размерах, пятна и инфильтративные элементы превращаются в опухоли различных размеров с частым поражением внутренних органов. Важной особенностью этого типа CK является полное исчезновение проявлений CK у 24—80 % больных после снижения дозы или полной отмены иммуносупрессивных препаратов, причем ремиссия может наступить даже при наличии специфических висцеральных поражений. Поражения снова возникают при возобновлении иммуносупрессивной терапии. Отмечено, что ИССК у реципиентов почечного трансплантата протекает более агрессивно, чем у больных системными заболеваниями, получавшими иммуносупрессивную терапию. Первичные высыпания у реципиентов быстрее трансформируются в узлы, чаще становятся генерализованными с вовлечением в процесс слизистых оболочек полости рта и половых органов, а также внутренних органов. Вирусы и онкопатология. Официальная статистика регистрирует в мире ежегодно 10 млн случаев рака, причем 30 % злокачественных опухолей являются вирусозависимыми, т. е. имеют повышенный или высокий риск развития в присутствии в организме вирусных инфекций. В структуре онкологической заболеваемости населения Санкт-Петербурга вирусозависимые опухоли составляют у мужчин около 40 %, у женщин — более 30 %. Ежегодно происходит 6 млн смертей от рака, у 22 млн человек отмечено это заболевание. Доказано, что вирусы папилломы человека (ВПЧ) — единственная группа вирусов, которые индуцируют образование опухолей у человека в естественных условиях. Американские исследователи считают, что в мире 300 млн женщин (примерно столько же и мужчин) старше 15 лет имеют вирусоносительство ВПЧ. Около 60 млн женщин и мужчин ежегодно заболевают вирусозависимой онкопатологией: поражение гениталий, анальной области, полового члена, кожи. ВОЗ прогнозирует увеличение человеческой популяции и ее старение, в связи с чем к 2020 г. ожидают рост числа случаев заболевания раком до 15 млн и около 10 млн смертей. ВПЧ способствует развитию: — рака шейки матки в 99,7 %; — рака вульвы, влагалища, полового члена, предстательной железы, яичка в 10—30 % случаев; — рака анальной области в 10—30 % случаев; — рака гортани и ротовой полости в 10—30 % случаев. В Санкт-Петербурге в 2002 г. от злокачественных опухолей умерло 12 762 человек, из них 6753 женщины. От рака шейки матки в течение года умирает более 200 человек, от рака прямой кишки — более 350 мужчин и более 430 женщин, от рака предстательной железы — более 340 мужчин, от рака ротовой полости — более 300 мужчин. На основании способности ВПЧ индуцировать неопластические процессы их принято подразделять на разновидности низкого (6,11, 42, 43, 44-й тип), среднего (31, 33, 35, 51, 52, 58-й тип) и высокого (16, 18, 45-й тип) онкологического риска. В последнее время с раком цервикального канала шейки матки (95 %) связывают 15 типов ВПЧ. Среди них наиболее часто выявлются ВПЧ-16 (50 %) и ВПЧ-18 (10 %), в связи с чем женщины с подтвержденной ВПЧ-инфекцией должны ежегодно проходить осмотр у гинеколога с кольпоскопией, цитологическим исследованием цервикальных мазков, вирусологическое и иммунологическое обследование. Считают, что в 50 % случаев папиллома-вирусной инфекции вирус выводится из организма женщины в течение 1 года, а в 85 % случаев — в течение 4 лет. В последние годы показана связь ВПЧ с дисплазией и плоскоклеточным раком шейки матки, а также раком кожи головы и шеи. Неблагоприятно одновременное персистирование ВПЧ-16, ВПЧ-18 типа в сочетании с ВПГ-1, так как последний стимулирует не только репликацию ВПЧ, но способствует интеграции его генома в геном клетки-хозяина, что является одним из условий опухолевой трансформации. Герпесвирусы — кофакторы прогрессирования ВИЧ-инфекции и СПИДа. Генный полиморфизм ВПЧ и мутации некоторых генов в организме пациентов могут быть важными факторами предрасположенности к злокачественной патологии клеток шеечного эпителия. Например, мутации генов ВПЧ (варианты генов Е2, Е6—Е7) у больных с ВПЧ-инфекцией могут определять повышенный риск предраковой патологии, очевидно, путем модуляции репликации и интеграции вируса в геном человека. Показано, что ДНК ВЭБ обнаруживается в пробах из шейки матки в 18—38 % случаев у здоровых женщин и пациенток дерматовенерологических стационаров, поэтому необходимо продолжать изучение роли ВЭБ в развитии цервикальных дисплазий. Неблагоприятна сочетанная персистенция ВПЧ с ВПГ-2, ЦМВ, ВЭБ, ВИЧ, хламидиями и микоплазмами. В Санкт-Петербурге за период 2001—2002 гг. обследовано на вирусы ВПЧ, ЦМВ, ВЭБ, ВГ (вирусы гепатитов) цитологическим методом и с использованием ПЦР 252 женщины 25—50 лет с вульво-вагинальной патологией (вульвит — у 232 женщин, лейкоплакия и крауроз вульвы — у 8, кандилома вульвы — у 10, рак вульвы — у 2 больных). Анализ частоты выявления вирусных заболеваний показал, что у 68,3 % больных обнаружен ЦМВ, у 66,6 % — ВЭБ, у 20,6 % — ВПЧ-16 и ВПЧ-18 типов, у 5,5 % — вирусы гепатитов, в 19,4 % случаев наблюдалось сочетание нескольких вирусов. Авторы предложили систему профилактических мероприятий, направленных на снижение заболеваемости населения вирусозависимыми злокачественными новообразованиями. Комплексная программа включает цитологические методы, обследование на вирусы (ВПЧ, ЦМВ, ВЭБ, вирусы гепатитов). Обнаружение вирусов высокого онкологического риска (ВПЧ-16, ВПЧ-18 типов) обязывает дополнить обследование уточняющими методами диагностики: определение уровня пролактина, пролактин/тиреотропный гормон (ТТГ) в крови, генное тестирование ВПЧ (соотношение генов Е2—Е6), составление карты генетического риска пациента. Это позволяет предложить пациенту индивидуальную модель стратегии и тактики лечения и наблюдения, а также сформировать группы риска вирусозависимых опухолей. | |
|
| |
| Всего комментариев: 0 | |