12:46 Клиника герпесвирусных инфекций | |
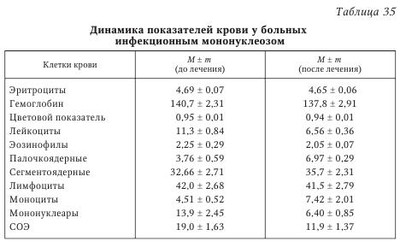
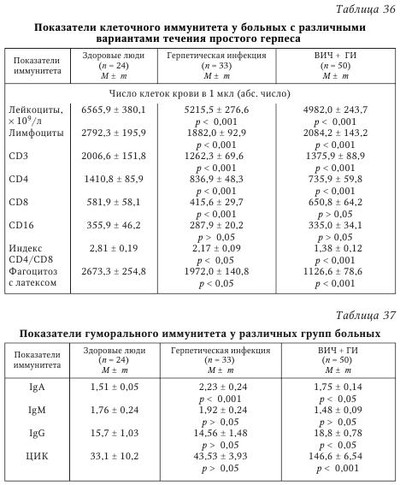
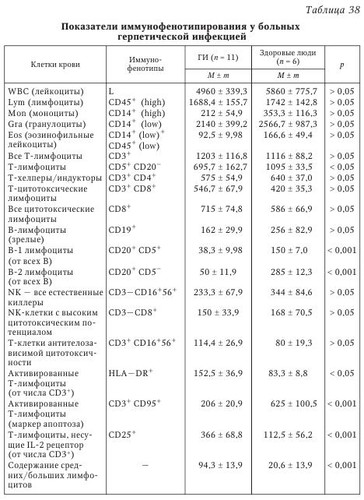
Проведен анализ клинических симптомов больных с опоясывающим герпесом и инфекционным мононуклеозом, госпитализированных в Новгородскую городскую инфекционную больницу. Всего под наблюдением было 20 больных с опоясывающим герпесом: женщин — 12 (60 %), мужчин — 8 (40 %). Средний возраст — 57,3 года, в том числе: в возрасте 0—19 лет — 1 пациент, 20—39 лет — 3 пациента, 40—59 лет — 5 человек, 60 лет и старше — 11 больных. Среди клинических форм ОГ наиболее часто встречались ганглиокожная — 15 (75 %) и кожная — 5 (25 %). У больных с ОГ преобладали следующие клинические симптомы: экзантема — у 20 больных (100 %); боли — у 20 больных (100 %); зуд — у 1 больного (5 %); парестезии — у 1 больного (5 %); интоксикация — у 12 больных (60 %). Увеличение СОЭ отмечалось у 9 пациентов (в 45 % случаев), разброс увеличенных показателей СОЭ регистрировался от 15 до 34 мм/ч. Лимфоцитоз отмечался у 7 больных (35 %), причем максимальное увеличение лимфоцитов наблюдалось до 67 % в поле зрения. У больных в остром периоде заболевания отмечаются повышенное количество лимфоцитов, увеличенная СОЭ, а после приема противогерпетических препаратов постепенно восстанавливаются вышеперечисленные показатели крови (снижается количество лимфоцитов, уменьшается СОЭ), что свидетельствует об эффективности проводимой терапии и уменьшении выраженности клинических симптомов. У наблюдаемой группы больных выявлены осложнения в виде серозного менингита (5 % больных). Зарегистрированы сопутствующие заболевания: диффилоботриоз — у 5 % пациентов, злокачественная лимфома — у 5 %, бронхит — у 10 %, хронический холецистит — у 5 %, хронический гастрит — у 15 %, гипертоническая болезнь — у 15 % больных. У 70 % больных ОГ неврологический синдром сохраняется от 2 нед. до нескольких лет. С инфекционным мононуклеозом (ИМ) находилось под наблюдением 39 больных, из них 20 женщин и 19 мужчин. По возрастному составу: 0—14 лет — 1 ребенок, в возрасте 15—19 лет — 28 больных, 20—29 лет — 9 больных, 30—49 — 1 человек, в возрасте 50 лет и старше пациентов не было. Продолжительность лечения была различной в разных возрастных группах; средний койко-день составил — 14,3; минимальный — 5; максимальный — 21. Социальный состав данной группы больных был следующим: служащие — 1 человек, работающие — 2 человека, учащиеся — 36 человек, в том числе школьники — 16 пациентов, учащиеся ПТУ — 8, студенты — 12. Основные клинические симптомы ИМ: лимфаденопатия, гепатомегалия, интоксикационный симптом и катаральные изменения в зеве. При этом лимфаденопатия с типичным увеличением затылочных лимфоузлов выявлена у 12 больных (в 30,76 % случаев), заднешейных лимфоузлов — у 11 больных (28,2 %). Увеличение подчелюстных лимфоузлов было у 31 больного (79,48 %), подмышечных — у 4 больных (10,25 %), надключичных — у 5 больных (12,82 %), паховых — у одного больного (2,5 %). Гепатомегалия была выявлена у 15 больных (38,46 %); спленомегалия — у 2 больных (5,12 %); сыпь — у 3 больных (7,69 %), острые катаральные явления — у 39 (100 %), интоксикация — у 31 (79,48 %) больного. Увеличение СОЭ наблюдалось в 23 случаях (максимальное увеличение — до 46 мм/ч), лимфоцитоз — у 25 больных (максимальное увеличение — до 73 % от общего числа лейкоцитов), обнаружение атипичных мононуклеаров свыше 10 % всех лейкоцитов — у всех больных. В остром периоде заболевания у больных инфекционным мононуклеозом отмечались лейкоцитоз 11,3 ± 0,84, увеличение числа одноядерных элементов (лимфоцитов, атипичных мононуклеаров) и СОЭ (табл. 35). После 2 нед. лечения наблюдались снижение лейкоцитов до показателей нормы (6,56 ± 0,36), уменьшение числа атипических мононуклеаров с 13,9 ± 2,45 при поступлении до 6,40 ± 0,85 после лечения. У больных сохранялась мононуклеарная реакция, в основном за счет лимфоцитов, хотя имелась тенденция к снижению их числа. Данная реакция описывается многими авторами и может сохраняться в течение 3—6 мес. и даже нескольких лет. Показатели СОЭ после лечения больных снижались до нормы с 19,0 ± 1,63 до 11,9 ± 1,37 мм/ч. У больных с инфекционным мононуклеозом были выявлены следующие осложнения: паратонзиллит — у 1 больного, паратонзиллярный абсцесс — у 1 больного. Всем больным проводилась общепринятая базисная терапия: антибактериальная, дезинтоксикационная, симптоматическая и иммуномодулирующая. Противовирусные препараты назначались только больным с ОГ: ацикловир, неовир. Исследован иммунологический статус у 33 больных с ГИ, находившихся на лечении в городской инфекционной больнице г. Великого Новгорода (табл. 36 и 37). Полученные данные сравнивали с иммунологическими показателями диспансерной группы (50 ВИЧ-инфицированных пациентов с клиническими проявлениями простого герпеса) (ВИЧ + ГИ). Как видно из табл. 36, большая часть показателей клеточного иммунитета в группах больных достоверно отличается от показателей здоровых лиц. Так, общее количество лейкоцитов в группе больных ГИ и ВИЧ + ГИ снижено по сравнению с аналогичным показателем у здоровых лиц. Абсолютное количество лейкоцитов также достоверно отличается от нормы в группах больных ГИ и ВИЧ + ГИ. Количество CD3 клеток (общее число Т-лимфоцитов) повторяет закономерность изменений вышеуказанных показателей: лейкоцитов и лимфоцитов, которые больше снижены в группе ГИ. Показатели CD4 клеток, преимущественно выполняющих функцию Т-хелперов, достоверно снижены в обеих группах больных, больше в группе ВИЧ + ГИ. Так как фенотипы CD4 являются в определенной степени рецептором для связывания с ВИЧ, то они закономерно вовлекаются в патологический процесс с постепенным их разрушением и уменьшением содержания в периферической крови. А вирус герпеса, вероятно, индуцирует ВИЧ и способствует более быстрому разрушению клеток-мишеней вируса, в том числе CD4 лимфоцитов. Известно, что ГВ являются кофакторами активации и прогрессирования ВИЧ-инфекции и СПИДа. Содержание субпопуляции лимфоцитов CD8, представляющих преимущественно цитотоксические клетки, достоверно снижено только в группе больных с ГИ. При сочетанном течении ВИЧ и ГИ, когда присутствуют в организме два конкурирующих вируса, содержание CD8 клеток достоверно не отличается от показателей здоровых лиц (р > 0,05). Фенотипы этих клеток не являются мишенью для ВИЧ, и их повышение связано не с вовлечением в патологический процесс, а с более низким содержанием других фенотипов клеток, то есть повышение CD8 клеток можно расценивать как относительное повышение. Количество CD16 клеток, выполняющих преимущественно киллерную функцию, которые принято считать естественными (натуральными) киллерами, достоверно не отличается от аналогичных показателей здоровых лиц (р > 0,05) во всех группах наблюдений. По литературным данным известно, что натуральным киллерам в основном отводится роль в противоопухолевой защите. При вирусных инфекциях, в частности при ГИ, данная субпопуляция клеток имеет определенное значение на начальном этапе развития заболевания, возможно, поэтому в наблюдаемых группах больных содержание CD16 клеток существенно не отличается от нормы. Особую диагностическую и прогностическую значимость при инфекциях, связанных с ВИЧ, имеет иммунорегуляторный индекс CD4/CD8. Указанный показатель значительно снижен в группе ВИЧ + ГИ (р < 0,001) и менее существенно его снижение у больных ГИ (2,17 ± 0,09 и 2,81 ± 0,19 соответственно). Показатели фагоцитоза с латексом достоверно отличаются в группах наблюдаемых больных от показателей здоровых лиц. Так, при ГИ они составили 1972,0 ± 140,8 (р < 0,05), при ВИЧ + ГИ — 1126,6 ± 78,6 (р < 0,001) по сравнению с показателями 2673,3 ± 254,8 (р > 0,05) у здоровых лиц. Полученные результаты указывают на более выраженную фагоцитарную активность клеток, обусловленную TB. Показатели гуморального иммунитета в меньшей степени, чем показатели клеточного иммунитета, изменяются в наблюдаемых группах больных (см. табл. 37). В то же время некоторые показатели гуморального иммунитета отличаются от аналогичных показателей здоровых лиц. В частности, содержание IgA достоверно увеличено во всех группах больных. У больных ГИ уровень IgA составил 2,23 ± 0,24 г/л белка, у пациентов ВИЧ + ГИ содержание IgA было 1,75 ± 0,14 г/л белка по сравнению 1,5 ± 0,05 г/л белка у здоровых лиц. Известно, что IgA является секреторным иммуноглобулином, и он в определенной степени обеспечивает местный иммунитет на уровне слизистых оболочек. Его увеличение обеспечивает защиту организма от инфекции на местном, тканевом или органном уровне. Данные наших исследований по изучению IgA при ГИ совпадают с результатами других авторов. Однако в нашем исследовании установлено, что при сочетанном течении ГИ на фоне ВИЧ содержание IgA увеличено в меньшей степени, чем в группе больных с герпетической моноинфекцией. Возможно, более низкое значение IgA свидетельствует о высокой антигенной нагрузке (ВИЧ и ВПГ), что указывает на меньшую перспективу элиминации возбудителей с сохранением достаточно высокой антигенемии. Содержание циркулирующих иммунных комплексов (ЦИК) достоверно увеличено в группе пациентов с ВИЧ + ГИ (146,6 ± 6,54 оптических единиц плотности). При одновременном присутствии в организме двух вирусов замедляется элиминация ЦИК из организма, так как в освобождении организма от иммунных комплексов принимают участие почти все клетки и цитокины иммунной системы. Выявлено понижение показателей клеточного иммунитета особенно в группе ВИЧ + ГИ, что приводит к ослаблению иммунного ответа и накоплению ЦИК в организме. Высокие уровни ЦИК на фоне повышенных показателей IgG имеют негативное патофизиологическое значение, так как ЦИК могут откладываться на клетках эндотелия сосудов, клеточных мембранах и нарушать их целостность. Следовательно, у больных ВИЧ + ГИ в большей мере, чем при моногерпети-ческой инфекции, страдает неспецифическая резистентность организма, что может также служить дополнительным лабораторным критерием тяжести течения инфекции. Таким образом, установлено снижение основных показателей клеточного иммунитета, особенно CD4 фенотипа лимфоцитов, при ГИ и в большей степени — при ВИЧ + ГИ. Отмечается увеличение содержания IgA и ЦИК. По мнению Г. Т. Сухих с соавт., общая схема иммунного ответа на ГИ может быть представлена следующим образом. Иммунный ответ организма человека на вирусную инфекцию делится на две фазы — фазу локализации вируса на ограниченной анатомической площади и фазу позднего специфического воздействия, в течение которой локализованная инфекция удаляется. Часть больных с ГИ обследовалась высокоточным и информативным методом проточной цитометрии (табл. 38). Некоторые показатели крови достоверно отличаются от показателей здоровых лиц, другие показатели достоверно не изменяются. Так, общее количество лейкоцитов, лимфоцитов, моноцитов и гранулоцитов не отличается от показателей здоровых лиц. Тогда как число Т-лимфоцитов, несущих CD5, снижено у больных по сравнению с нормой (р < 0,05). Хотя все Т-лимфоциты, несущие CD3 фенотип, достоверно не отличаются от аналогичных показателей у здоровых лиц. Количество Т-хелперов/индукторов, несущих CD3+, CD4+, несколько ниже, чем в группе здоровых лиц, но достоверно не отличается. В пределах нормы показатели цитотоксических клеток и В-лимфоцитов зрелых субпопуляций, несущих CD19. B1- и В2-лимфоциты, несущие соответственно иммунофенотипы CD20+ CD5+ и CD20+ CD5-, достоверно ниже нормы. Снижение всех клеток, несущих иммунофенотипы CD20, отвечающих за синтез антител, вероятно, способствует низкому накоплению противогерпетических антител, что может быть одной из причин персистенции вирусных антигенов. Все натуральные киллеры, несущие CD16+ CD56+, при полном отсутствии CD3-, не отличаются от нормальных показателей, хотя имеют тенденцию к снижению абсолютного числа. Натуральные киллеры (NK-клетки) с высоким цитотоксическим потенциалом, несущие CD8+, но при отсутствии CD3, не достоверно отличаются от нормы, имеют тенденцию к снижению. Т-клетки антителозависимой цитотоксичности, несущие CD3+ CD16+ CD56+, не достоверно увеличиваются, хотя коэффициент t приближается к значениям, близким к достоверности. Следовательно, идет активация MHC-DR локусов неспецифической цитотоксичности, за что отвечает CD56, и специфической цитотоксичности, несущих CD3+ CD16+. Количественное содержание активированных Т-лимфоцитов (от числа CD3+), несущих иммунофенотипы HLA-DR, достоверно снижается (р < 0,05) по сравнению с показателями у здоровых лиц. По-видимому, при ГВИ активизируется иммунный ответ в плане распознавания чужеродной информации и его реализации. Исследованиями выявлено снижение в 3 раза числа активированных Т-лимфоцитов, несущих апоптотический маркер CD95, среди CD3, по сравнению с нормой (206 против 625, р < 0,001). Эти данные свидетельствуют о преждевременной гибели иммуннокомпетентных клеток, в том числе Т-лимфоцитов, участвующих в противовирусной защите. Возможно, вирус герпеса обладает способностью индуцировать гены апоптоза Т-лимфоцитов, тем самым обеспечивая самосохранность в организме. Содержание Т-лимфоцитов, несущих ИЛ-2 рецепторы (от числа CD3), иммунофенотипа CD25+ достоверно увеличено по сравнению с нормой, они отвечают за активацию и пролиферацию цитотоксических T-лимфоцитов. Действительно, содержание CDS-клеток, отвечающих за цитотоксичность, имеет тенденцию к увеличению. Несмотря на увеличение указанных фенотипов, функционально они не обеспечивают цитотоксичность, что, вероятно, связано с более быстрой их гибелью. Установлено снижение апоптотических иммунофенотипов CD95 среди Т-лимфоцитов, которые отвечают за активацию запрограммированной гибели клеток. Выявлено достоверное снижение СБ20-клеток, отвечающих за гуморальное звено иммунитета, поэтому нарушается нейтрализация вируса, происходит его накопление и персистенция в организме. Содержание средних/больших лимфоцитов достоверно увеличено по сравнению с нормой, но эти клетки не способны полноценно участвовать в иммунном ответе, тем более что в общей популяции лимфоцитов содержание этих клеток значительно ниже и они не способны компенсировать недостаточность иммунной системы в элиминации ВПГ из организма. Таким образом, при ГВИ присутствует недостаточность как клеточного, так и гуморального звеньев иммунитета, обусловленная уменьшением продолжительности жизни клеток, а также снижением содержания некоторых фенотипов (CD20) иммунокомпетентных клеток. Совокупность выявленных иммунологических изменений может способствовать персистенции вирусов герпеса в организме и рецидивирующему течению болезни. Необходимо отметить, что формирование иммунитета при ГВИ является сложным и многокомпонентным процессом, в ходе которого клеточная кооперация может нарушаться на различных этапах. Так, например, активность макрофагов, характер вирусной инфекции и доставка вирусспецифического антигена В-лимфоцитам на индуктивной стадии герпеса определяет резистентность организма к этой инфекции. С другой стороны, решающее влияние на исход ГИ оказывает специфический клеточный иммунитет, опосредованный Т-лимфоцитами. Состояние клеточного иммунитета человека в значительной степени определяет характер течения ГИ, частоту и интенсивность рецидивов. Однако еще многое неизвестно в механизме клеточного иммунитета. Например, что способствует или, наоборот, прерывает рецидивы инфекции? От продукции антител В-лимфоцитами и от взаимодействия Т-лимфоцитов с инфицированными клетками зависит развитие и состояние приобретенного иммунитета. Учитывая это, терапию ГВИ необходимо направлять не только на усиление клеточного звена иммунитета, но и на повышение гуморального иммунитета (В-клеток: В-активина, В-миелопина). | |
|
| |
| Всего комментариев: 0 | |