13:20 Легочная гипертензия новорожденных | |
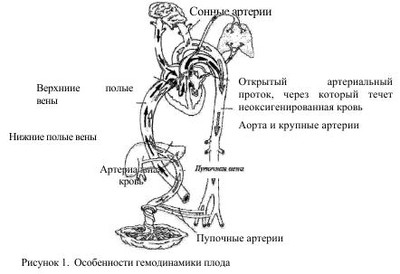
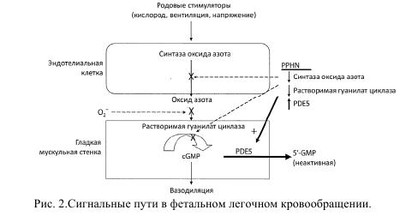
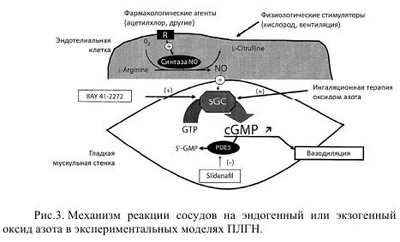
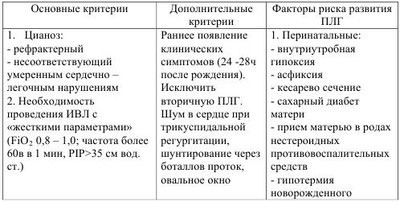
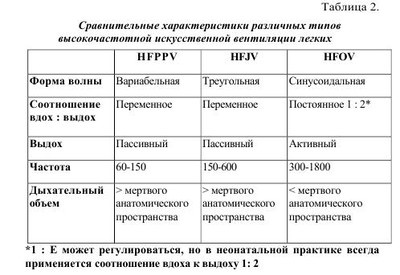
Легочная гипертензия новорожденных - это клинический синдром, характеризующийся отсутствием возможности легочного кровообращения снижать или поддерживать уже сниженное легочное сосудистое сопротивление при рождении, сопровождается выраженной легочной гипертензией и, вследствие этого, право-левым внутрисердечным шунтированием крови и рефрактерной артериальной гипоксемией. Шунтирование происходит через открытый артериальный проток (ОАП) и/или овальное окно при отсутствии сопутствующих пороков сердца. Приблизительно в 20% случаев шунт происходит только через овальное окно. По различным данным, персистирующее фетальное кровообращение (ПФК) встречается у 8-20% детей с легочной гипертензией и развивается на фоне легочных, внелегочных и сердечных патологических процессов. Без использования современных методов интенсивной терапии и реанимации смертность среди таких больных может достигать 80%. Код по МКБ-10- Р29.3 Стойкое фетальное кровообращение у новорожденных. Впервые термин «персистирующее фетальное кровообращение» (ПФК) был предложен Герсони в 1969 году и характеризовался как состояние при котором у новорожденных, находившихся на искусственной вентиляции легких 100% кислородом, наблюдалась выраженная гипоксемия с РаO2 менее 37,5 мм рт.ст. при структурно нормально сформированном сердце. В последующем вместо ПФК стал более популярным термин «легочная гипертензия». Легочная гипертензия (ЛГ) подразделяется на «транзиторную легочную гипертензию» (ТЛГ) и «персистирующую легочную гипертензию» (ПЛГ), среди вариантов которой выделяют идиопатическую ЛГ - синоним первичной ПФК. Как правило, причиной ТЛГ является гипоксия любого генеза, причиной ПЛГ - хроническая внутриутробная гипоксия. Принято различать первичную и вторичную формы ЛГ. • Первичная ЛГ развивается у новорожденных, не имеющих клинические и рентгенологические признаки легочной патологии. Стойкая гипоксемия развивается вскоре после рождения, но при этом уровень РаСO2 остается нормальным или умеренно сниженным. Возможной причиной является первичное нарушение функции механизмов легочной вазодилятации. • Вторичная ЛГ возникает у новорожденных с тяжелыми, преимущественно паренхиматозными, заболеваниями легких и усложняет их течение и прогноз. Чаще ЛГ сопровождает синдром аспирации меконием (САМ), пневмонии, респираторный дистресс-синдром (РДС), диафрагмальные грыжи и другие формы легочной гипоплазии. Легочная вазоконстрикция при этом в значительной степени связана с гипоксией. По сводным данным, частота ПЛГ составляет 1-3 на 1000 живорожденных, наиболее типичны для доношенных и переношенных новорожденных. Частота ПЛГ почти в 5 раз чаще наблюдается у детей, извлеченных путем кесарева сечения, по сравнению с детьми, рожденными через естественные половые пути. Длительное время считалось, что недоношенные дети имеют недостаточно развитый мышечный слой в артериолах для того, чтобы поддерживать высокое легочное сосудистое сопротивление после рождения, но, по современным представлениям, около 15%-35% детей с ПЛГ составляют недоношенные дети. Развитие гладкой мускулатуры, окружающей легочные артериолы, происходит ближе к концу гестации (более 28 недель), поэтому легочная гипертензия -проблема чаще встречающаяся у переношенных, доношенных и недоношенных детей старше 34 недель гестации. Эмбриональное легочное кровообращение испытывает сильные изменения в структуре и функциях сосудов в процессе их роста. Ввиду того, что плацента, а не легкое, служит органом обмена газа, менее чем 10% смешанной крови, изгнанной из желудочка, циркулирует через легочную сосудистую систему, а большинство крови из правого желудочка выходит в артериальный проток, поступает в аорту, откуда через восходящую аорту к верхним конечностям и голове (рис. 1). Несмотря на повышение давления в легочной сосудистой системе, легочное сосудистое сопротивление (PVR) повышается вместе с увеличением гестационного возраста, т.е. сосудистый тонус плода возрастает к концу беременности и остается высоким до начала рождения. Таким образом, давление в легочной системе внутриутробно равноценно системному давлению благодаря повышенному легочному сосудистому сопротивлению. Перед рождением плод должен быстро подготовить свою кардиореспираторную систему к новым требованиям внеутробной жизни. Если новорожденные в состоянии достичь или подтвердить нормальное уменьшение легочного сосудистого сопротивления сразу после рождения, результатом являются дыхательные расстройства, гипоксемия и, как следствие, ПЛГ. Регуляция легочного кровотока обеспечивается за счет баланса между факторами, которые вызывают активное сужение легочных сосудов и теми, которые вызывают расширение на фоне начавшегося дыхания (табл. 1). Легочный сосудистый кровоток после рождения характеризуется быстрым повышением давления, снижением легочного сосудистого сопротивления и очистки легкого от фетальной жидкости. Легочные эндотелиальные клетки играют важную роль в легочном сосудистом сопротивлении, воздействуя через многочисленных посредников на гладкомышечные клетки сосудов. Первоначальными продуктами эндотелиальных клеток, ответственными за сосудистое легочное сопротивление являются окись азота и метаболиты арахидоновой кислоты. Продукция оксида азота критически возрастает в момент рождения. Выброс эндотелиальными клетками легких двух синтетаз - окиси азота (eNOS) и растворимую гуанилатциклазу (sGC), возрастает в конце беременности. В конечном счете, увеличение продукции оксида азота и гуанилатциклазы активирует синтез циклического гуанозинмонофосфата (cGMP), находящихся в гладкомышечных клетках сосудов, которые усиливают вазорелаксацию за счет снижения концентрации внеклеточного кальция (рис. 2). В первые минуты после родов, для обеспечения нормальной жизнедеятельности, высокое легочное сопротивление, которое было во внутриутробном периоде, должно подвергнуться резкому падению. Это падение легочного сосудистого сопротивления (ЛСС) позволяет восьмикратно увеличивать легочный кровоток, а также позволяет легким стать органом, участвующим в газообмене. Такие механизмы, как повышенное напряжение кислорода, вентиляция, shear stress, участвуют в нормальном падении легочного сопротивления при рождении. Эти физиологические стимулы непосредственно снижают ЛСС путем изменения продукции некоторых вазоактивных веществ: повышения свободных эндогенных дилятаторов таких как оксид азота (NO) и простоциклин (PgI2) и снижение активности вазоконстрикторов, таких как эндотелии-1(ET-1). В течении нескольких минут после родов высокий легочной кровоток внезапно повышает shear stress и расширяет сосудистую мускулатуру, приводя к структурной реорганизации стенок сосудов, которая включает в себя уплощение эндотелия и утоньшение гладкомышечных клеток и матрикса. Таким образом, возможность приспособиться к повышению кровотока требует быстрой функциональной и структурной адаптации, чтобы обеспечить нормальное послеродовое снижение напряжения в легочных сосудах. Некоторые новорожденные не могут достичь или поддержать нормального снижения ЛСС при рождении, что приводит к серьезному респираторному дисстресу и гипоксемии, которые обозначаються как ПЛГН. Этот симптомокомплекс является серьезной клинической проблемой у доношенных и недоношенных новорожденных. Сигнальные пути NO и простациклина в регуляции сосудистого тонуса. NO синтезируется нитроксид синтетазой (NOS) из терминальных нитрогеновых групп L-аргинина. NO стимулирует гуанилатциклазу для увеличения внутриклеточной cGMP. Простациклин (PGI2) - метаболит арахидоновой кислоты, который формируется циклооксигеназой (СОХ-1) и простациклинсинтетазой (PGIS) в сосудистом эндотелии. PGI2 стимулирует аденилатциклазу в гладкомышечной клетке сосудов, которая повышает внутриклеточный сAMP. cGMP и с AMP не напрямую снижают концентрацию кальция, что приводит к миорелаксации и, затем, к вазодилятации. Специфические фосфодиэстеразы гидролизируют cGMP и сАМР и таким образом регулируют интенсивность и продолжительность их сосудистых эффектов. Путь образования простациклина - это другой потенциально важный вазодилятаторный путь при нормальном переходе к внеутробной жизни. Циклооксигеназа (СОХ) - это энзим, который превращает простоциклин из арахидоновой кислоты. Как СОХ-1, так и СОХ-2 найдены в легком, но COX-I является регулятором, образующимся в позднем сроке гестации. Есть вероятность, что рост концентрации эстрогенов в позднем периоде гестации может играть роль в регулировании синтеза PGG, что приводит к росту продукции простациклина в позднем периоде беременности и раннем неонатальном периоде. Простациклин взаимодействует с аденилатциклазой, чтобы увеличить уровень межклеточного сАМР, который приводит к вазорелаксации. Во время рождения многие факторы регулируют вышеупомянутые пути. Самым критическим моментом для таких переходных состояний является механическое расправление легких, уменьшение уровня углекислоты и нарастание уровня кислорода в легких. В эксперименте на ягнятах доказано, что при вентиляции без изменения напряжений углекислоты или кислорода, поток легочной крови сразу после рождения возрастает приблизительно в два-три раза. Кислород стимулирует деятельность как eNOS, так и COX-1 сразу после рождения, приводя к увеличению уровня NO и простациклинов. Кислород также стимулирует реакцию аденозинтрифосфата в оксигенированных эритроцитах, которые усиливают деятельность как eNOS, так и СОХ-1. Газовый и кислотно-основной гомеостаз оказывает мощное влияние на легочную циркуляцию (рис. 3). Противоположное воздействие оказывает высокий уровень углекислого газа в крови. Повышение парциального давления СО2 обладает прямым вазоконстрикторным эффектом на легочные сосуды. Алкалоз понижает легочную вазоконстрикцию, вызванную гипоксией, но не устраняет ее полностью. Соответственно, повышение концентрации водородного иона (снижение pH) вызывает спазм легочных сосудов. Механизмы, отвечающие за развитие ПЛГН при нарушении газового и кислотно-основного гомеостаза, можно представить следующим образом: 1. Угнетение процессов окислительного фосфорилирования нарушение внутриклеточного соотношения между АТФ и АДФ способствует интрацитоплазменному увеличению концентрации кальция, приводящего к вазоконстрикции. 2. Увеличение уровня активных кислородных радикалов приводит к нарушению соотношения сульфгидрильных групп внутри внеклеточных кальциевых каналов. 3. Влияние на активность синтеза in situ вазоактивных пептидов (эндотелинов, лейкотриенов). По патогенетическому механизму возникновения ПЛГН условно можно разделить на несколько групп: A. Нормальная морфология сосудов легких на фоне нарушения функции миокарда или высокой реактивности легочных сосудов. 1. Асфиксия Гипоксия, гиперкапния, ацидоз. • Левожелудочковая недостаточность, приводящая к застойной венозной легочной гипертензии и последующей ЛГН с праволевым шунтом крови через ОАП и овальное отверстие. 2. Синдром аспирации мекония Сужение сосудов в результате альвеолярной гипоксии. • Возрастание сосудистого сопротивления за счет воздушных ловушек и перерастяжения легочной ткани. Сопутствующие эффекты тяжелого паренхиматозного повреждения. Морфологические изменения в легочных сосудах у некоторых детей. 3. Сепсис/пневмония Инфекция, приводящая к выраженной воспалительной реакции. • Высвобождение цитокинов и превышение нормального уровня в крови и активация других сосудистых медиаторов, увеличивающих сопротивление легочных сосудов. • Тяжелое повреждение легочной паренхимы, сопровождающееся выраженной гипоксией. 4. Синдром дыхательных расстройств • Болезнь гиалиновых мембран. • Транзиторное тахипноэ. • «Шоковое легкое». 5. Тромбообразование с высвобождением вазоактивных медиаторов 6. Синдром «повышенной вязкости крови» (полицигемия, увеличение концентрации белка в плазме крови и др.). B. Морфологические нарушения в легочных сосудах 1. Снижение объема сосудистого русла за счет мускулинизации стенки прекапиллярных артериол, на фоне хронической внутриутробной гипоксии. -Внутриутробное закрытие артериального протока. -Идиопатическая ПЛГН. 2. Снижение площади васкулярного ложа на фоне гипоплазии легких -Первичная гипоплазия легких. -Врожденная диафрагмальная грыжа. -Поликистоз легких. Другие врожденные пороки развития легких. С. Врожденные пороки сердца 1. Обструкция тракта выброса левого желудочка. 2. Аномалия легочного венозного возврата. 3. Аномалия Эбштейна. 4. Кардиомиопатия. 5. Другие структурные нарушения, в результате которых возникает шунт крови справа налево. Характерными признаками персистирующей легочной гипертензии у новорожденных являются: 1. Подозрение на ЛГ возникает, когда, несмотря на «жесткие» параметры вентиляции (пиковое давление на вдохе - PIP - 35 - 40 мм рт.ст., а в конце выдоха 4- 5 см вод.ст.) и использование больших концентраций кислорода (FiО2 более 0,4), у ребенка сохраняется выраженная гипоксемия, цианоз. Тахипное обычно не сопровождается втяжением уступчивых мест грудной клетки. 2.Отсутствие тяжелого паренхимального легочного заболевания для объяснения причин легочной гипертензии и наличие рентгенологических признаков для вторичной ПЛГН. При этом новорожденные могут иметь легочную патологию, например, САМ, РДС или постасфиксическую пневмопатию, но гипоксемия будет диспропорционально тяжелой для рентгенологических изменений и у больного не будет затруднения с элиминацией углекислого газа. Исключение могут составлять дети с тяжелым паренхимальным легочным заболеванием, имеющие высокое давление в легочной артерии, но при этом также имеющие высокое PaCO2, и тяжелая гипоксемия в этом случае будет вторична. Причина гипоксемии в этом случае - нарушение диффузии или внутрилегочное шунтирование крови . 3.Наличие право-левого шунта крови через ОАП, диагностированного при УЗИ сердца с применением допплерографии. При отсутствии ОАП шунт крови может быть обнаружен через овальное окно. 4.Эхокардиографическим методом доказанное отсутствие врожденных структурных аномалий сердца. Для диагностики ЛГ используют следующие функциональные тесты: 1. Гипероксический тест. Ребенку дают дышать чистым кислородом в течение 10 мин через маску или эндотрахеальную трубку. Тест сравнивает оксигенацию в крови до впадения и после впадения артериального протока, определяя SpO2 или PaO2 на правой руке и на левой ноге (артериальный проток впадает в аорту дистальнее места отхождения правой подключичной артерии). Тест считают положительным, если SpO2 справа больше на 20%, чем слева, a PaO2 справа больше на 15-20 мм рт.ст., чем слева. 2. Гипервентиляционный гипероксический тест. В течение 10-15 мин проводят гипервентиляцию с частотой 70 - 90/мин и FiО2 -1,0. Тест считают положительным при исчезновении цианоза, повышении Sp02 и увеличении РаО2 > 100 мм рт.ст. Гипероксия и гипервентиляция вызывают расширение легочных артерий и тем самым снижают легочное АД. Тест помогает исключить ВПС «синего» типа. Лабораторная диагностика включает в себя: 1. Клинический анализ крови, для исключения полицитемии, так как существует линейная зависимость между гематокритом и легочным сосудистым сопротивлением (при гематокрите выше 0,7 легочное сосудистое сопротивление увеличивается). 2. Ионограмма. Гипогликемия и гипокальциемия способствует снижению ударного объема сердца, что усиливает гипоксемию и снижение артериального давления, которые в свою очередь влияют на легочное сосудистое сопротивление и право-левое шунтирование. 3. Газовый анализ крови помогает выявить нарушения кислотнощелочного состояния. Рефрактерная гипоксемия является основным лабораторным диагностическим критерием ЛГ. Как последствие гипоксемии, отмечается стойкий метаболический ацидоз с pH крови < 7,25 и дефицитом BE больше (-10). Рентгенограмма грудной клетки в начальных стадиях выявляет обеднение малого круга кровообращения и «прозрачные» легкие, а при развитии сердечной недостаточности - отек легких и кардиомегалию. Рентгенологическое исследование выявляет и легочную патологию при вторичных формах ЛГ: врожденные аномалии легких и диафрагмы, синдром дыхательных расстройств, аспирационный синдром, пневмонии, баротравму паренхимы и др., при этом рентгенологическая картина не коррелирует с тяжелой рефрактерной гипоксемией. Также одним из способов диагностики степени легочной гипертензии у новорожденных является определение состояния легочной артерии, сердца и легочного рисунка. Дополнительно определяют величину индекса Мура, индекса Шведеля и кардиоторакального индекса (КТИ). При величине индекса Мура 36-40%, индекса Шведеля 0,4-0,5 см, КТИ 55-59% диагностируют ЛГ легкой степени; при величине индекса Мура 41-45%, индекса Шведеля 0,5-0,6 см, КТИ 60-64% диагностируют ЛГ средней степени; при величине индекса Мура > 46%, индекса Шведеля >0,7см, КТИ >65% диагностируют ЛГ тяжелой степени. Электрокардиография используется для исследования сердечной функции, структуры и гемодинамики в целом. Пульсоксиметрия или транскутанный мониторинг кислорода на участках кожи, кровоснабжающейся предуктальной (правая рука) и постдуктальной кровью (левая рука, ноги, грудь, живот) Метод эхокардиографии позволяет определить следующие показатели, очень важные для постановки диагноза «легочная гипертензия» и позволяющие подобрать адекватную терапию: • Наличие ВПС. • Выявления уровня, направления и значимости шунтирования крови через фетальные коммуникации ЛГ. • Определение величины давления в легочной артерии и его динамического контроля: • Оценка соотношения систолических временных интервалов легочного кровотока. • Определение транстрикуспидального градиента, оцениваемого по трикуспидальной регургитации. • Определение ряда косвенных критериев повышенного давления в легочной артерии: дилатация правых отделов сердца, плоское движение межжелудочковой перегородки, отсутствие мезо/протодиастолического коллапса «A-волной» клапана легочной артерии. Хоть и с приблизительной точностью, эти критерии нужно учитывать при комплексном эхокардиографическом исследовании новорожденных с подозрением на легочную гипертензию. • Оценку структуры сердца, его размеров и функции. Алгоритм диагностики ПЛГ у новорожденных Лечение легочной гипертензии имеет целью поддержание нормального уровня оксигенации крови и величины доставки кислорода к тканям. При этом в первую очередь ориентируется на два естественных фактора, обеспечивающих дилятацию легочных сосудов - уровень PaO2 и расправление легких. Лечение ЛГ включает в себя: 1. Общие мероприятия, направленные на поддержание температурного режима, как в родильном зале, так и в момент транспортировки; строжайшее соблюдение лечебно-охранительного режима; постоянный мониторинг витальных функций. 2. Коррекцию метаболических нарушений и кислотно-основного состояния крови, таких как: ацидоз, гипогликемии, гипокальциемии, анемии, полицитемии. 3. Поддержание системного артериального давления и адекватной перфузии тканей, путем проведения адекватной инфузионной терапии. 4. Улучшение альвеолярной оксигенации с помощью контролируемой ИВЛ. 5. Увеличение легочного кровотока: создание и поддержание преимущественно метаболического алкалоза (pH в пределах 7,45 - 7,55); использование селективных и общих вазодилататоров и инотропных препаратов; применение экстракорпоральных методов оксигенации. 6. Патогенетическая терапия, в дальнейшем с учетом антибиотикограммы При лечении новорожденных крайне важно поддерживать адекватный объем инфузионной терапии. С целью предупреждения у них гиповолемии и гипергидратации необходимо учитывать жидкостный баланс каждые 3-6 часов. Для оценки объема внутрисосудистой жидкости и степени гидратации можно прибегнуть к мониторингу центрального венозного давления. Постоянный мониторинг артериального давления обязателен, поскольку позволяет следить за тем, чтобы оно находилось на требуемом для этого состояния уровне (средний уровень артериального давления у доношенных должен превышать 50-55 мм рт.ст.). Поддержание системного артериального давления и адекватной перфузии тканей. Важным звеном лечения ПЛГН является поддержание адекватного сердечного выброса и системного артериального давления. Высокое системное давление уменьшает право-левый шунт крови через фетальные коммуникации, тем самым, увеличивая легочной кровоток и улучшая оксигенацию. Для коррекции анемии таким больным проводят трансфузии эритроцитной массы или отмытых эритроцитов. Важно поддерживать гематокрит больше или равным 40%, а гемоглобин больше 120 г/л. У детей с полицитемией напротив проводят гемодилюцию в объеме 10-15 мл/кг с целью улучшения реологических свойств крови. С момента рождения дети должны получать адекватное парентеральное питание, в том числе для повышения концентрации L-аргинина, являющегося предшественником эндогенного NO. Прежде всего, важно устранить гиповолемию, для чего должна проводиться адекватная инфузионная терапия, включающая в себя введение глюкозо-электролитных растворов, а также полноценное парентеральное питание. Для инотропной поддержки миокарда в настоящее время получило наибольшее распространение введение катехоламинов. Дофамин является эндогенным катехоламином, и при экзогенном введении оказывает комплексное дозозависимое действие на сердечно-сосудистую систему. В малых дозах (2-3 мкг/кг/мин) оказывает только вазодилатирующий эффект на артериолы почек и, возможно, сердце, мозга, брыжейки, обусловленный возбуждением допаминовых рецепторов. При этом улучшается диурез, перфузия тканей и снижается периферическое сосудистое сопротивление. Дозы от 5 до 10 мкг/кг/мин оказывают положительный инотропный эффект на миокард, обусловленный возбуждением адренорецепторов миокарда, а также высвобождением норадреналина из нервных окончаний. Уменьшение запасов норадреналина может привести к ограничению инотропного эффекта миокарда на дофамин. Дозы свыше 10мкг/кг/мин приводят к повышению периферического сосудистого сопротивления вследствие возбуждения а-адренорецепторов. При увеличении дозы свыше 15 мкг/кг/мин повышается легочное сосудистое сопротивление. Назначение и подбор дозы дофамина при лечении ПЛГН должен подбираться индивидуально для каждого пациента в зависимости от степени выраженности артериальной гипотензии, сердечного выброса, диуреза и периферической перфузии. В условиях выраженного метаболического ацидоза эффективность дофамина резко снижается. Внутривенные вазодилятаторы: Талазолин (наиболее популярный в/в вазодилятатор, у 50% больных приводит к значительной системной артериальной гипотензии); MgSО4 (магний является блокатором кальциевых каналов, антагонистом иона кальция, поступая в гладкомышечные клетки, способствует их вазодилятации; другие полезные эффекты: седативный, миорелаксирующий, бронходилятирующий, вызывает алкалоз; эффект у некоторых больных может наступить после нескольких часов лечения; возможные осложнения: системная гипотензия, гипогликемия, гипокалиемия); Простациклин; Нитропруссид натрия; Нитроглицерин; Аденозин/АТФ (расслабляет гладкую мускулатуру сосудов, повышая внутриклеточную концентрацию аденозин 3'5' монофосфата). Доказательные данные клинической эффективности внутривенных и ингаляционных (кроме NO) вазодилататоров отсутствуют и они пока не рекомендуются к широкому применению, но в критической ситуации их применение возможно оправдано. Внутривенные вазодилятаторы могут увеличивать кровоток в плохо вентилируемых областях легких, что ухудшит соотношение вентиляция/перфузия. Проводятся экспериментальные исследования по применению силденафрила у новорожденных детей с ПЛГ как активного вазодилятатора. Основным в лечении является стремление ликвидировать или уменьшить гипоксемию. Для поддержания у больного гипокапнии использовалась методика гипервентиляции на обычных аппаратах ИВЛ. Для этого приходилось значительно увеличивать параметры ИВЛ, что приводило к лишней баро- и волюмотравме легких, на фоне гипокапнии снижался мозговой кровоток и мозг пациента еще больше страдал от ишемии. В настоящее время, с появлением возможности поддерживать оксигенацию с меньшей агрессией для легких путем ВЧО ИВЛ, большинство неонатальных центров отказались от этой рутинной методики гипервентиляции. Впервые искусственную вентиляцию легких (ИВЛ) с положительным давлением (ИВЛПД, или сокращение по английскому термину «positive pressure ventilation» - «PPV») применили во время эпидемии полиомиелита в 1950-х годах. С тех пор подход к вопросам использования механической ИВЛ был скорее интуитивным, нежели научным, и был основан на применении правил нормальной физиологии. Главной целью ИВЛ является улучшение оксигенации и вентиляции. В настоящее время существует много режимов и методик ИВЛ. Несмотря на высокую значимость традиционных методов, в последнее время, особенно в тяжелых клинических ситуациях, на первое место в неонатологии выходит метод высокочастотной осцилляторной ИВЛ (ВЧО ИВЛ). Метаанализ исследований по сравнению эффективности ВЧО ИВЛ и традиционной ИВЛ показал, что при ВЧО ИВЛ значительно снижается частота хронических легочных заболеваний. Поэтому основной альтернативой традиционной ИВЛ является использование высокочастотной осцилляторной. В случаях, когда традиционная терапия не эффективна, применяется экстракорпоральная мембранная оксигенация (ЭКМО). До применения ЭКМО летальность среди новорожденных с тяжелой ПЛГН, получавших традиционную механическую вентиляцию, составляла 60-80%. ЭКМО приводит к повышению выживаемости у новорожденных с устойчивой, неподдающейся терапии, гипоксемией, но может приводить к кровотечениям, неврологическим и другим тяжелым нарушениям у доношенных детей. Такая терапия увеличивает выживаемость у новорожденных с дыхательной недостаточностью, но методика является весьма сложной, требует больших материальных затрат, имеется необходимость в большом количестве донорской крови. Летальность у новорожденных, леченных ЭКМО, составляет 15-20%, и еще 10-20% выживших новорожденных становятся тяжелыми инвалидами. Применение ВЧ ИВЛ позволяет избежать в большинстве случаев ЭКМО, а среди методов ВЧ ИВЛ наибольшей эффективностью обладает ВЧО ИВЛ, особенно при лечении РДС, САМ. Механическая вентиляция, проводимая с частотой дыхания 150-180 в минуту, использующая дыхательный объем больше, равный или меньше объема мертвого анатомического пространства, называется высокочастотной искусственной вентиляцией легких (ВЧ ИВЛ). При индексе оксигенации больше 20 ребенку показан превод на ВЧО ИВЛ. Различают три основных типа ВЧ ИВЛ: • High-frequency Positive Pressure Ventilation (HFPPV) — ИВЛ, проводимая специально адаптированными аппаратами с высокой частотой. Выделяют наиболее распространенный вариант - High-frequency Flow Interrupter Ventilation (HFFIV) — ИВЛ, при которой на фазе вдоха и выдоха создаются высокочастотные модуляции или осцилляции (пневмоперкуссия). • High-frequency Jet Ventilation (HFJV) - высокочастотная струйная вентиляция легких, обеспечивается вдуванием высокоскоростного прерывистого потока газа непосредственно в воздухоносные пути через трехпросветный адаптер. • High-frequency Oscillatory Ventilation (HFOV) - высокочастотная вентиляция производимая за счет колебательных движений поршня или диафрагмы. Моделирует активный вдох и выдох. Получила наибольшее распространение в неонатальной практике. ВЧО ИВЛ -представляет собой режим ИВЛ, при котором используется дыхательный объем равный или меньший, чем мертвое анатомическое пространство, причем используется частота вентиляции от 3 до 30 Гц. Данные таблицы 2 позволяет понять принципиальные различия между основными типами высокочастотной ИВЛ. В настоящее время для лечения ПЛГ в некоторых странах успешно используют комбинированную терапию ВЧОИВЛ с ингаляцией оксида азота. | |
|
| |
| Всего комментариев: 0 | |