10:56 Молекулярные механизмы уклонения вирусов от иммунной атаки | |
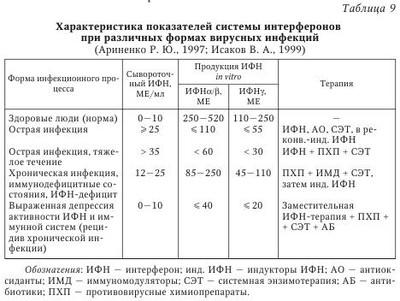
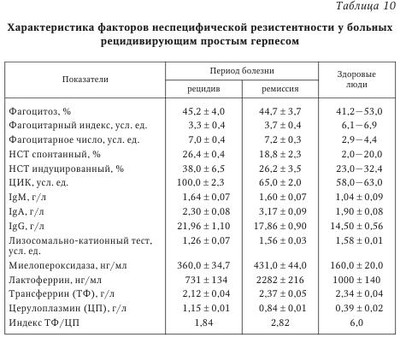
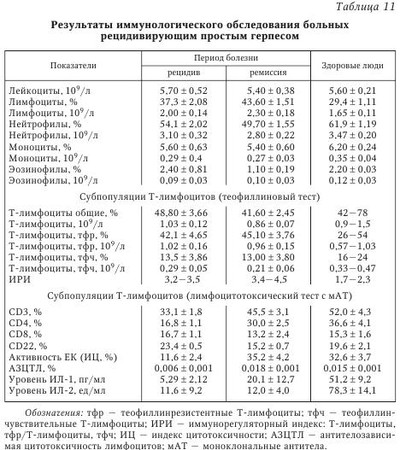
Сосуществование вируса и иммунокомпетентного хозяина требует установления баланса между скоростью репликации вируса и его элиминацией из организма с помощью иммунной системы, что в итоге обеспечивает выживание обоих видов. В арсенале иммунной системы находится огромное количество различных стратегических подходов к распознаванию и элиминации вирусов, в ответ на которые у вирусов произошла наработка всевозможных способов уклонения от обнаружения иммунной системой. Для вирусов с небольшими геномами (например, пикорнавиру-сов, миксовирусов и ретровирусов) характерны постоянное изменение строения их облочечных гликопротеинов и уклонение, таким образом, от распознавания иммунными клетками, что ограничивает презентацию иммунодоминантных вирусных пептидов на MHC-I молекулах. У вирусов с более протяженным геномом могут экспрессироваться более разнообразные белки, специфически влияющие на их распознавание и проявление против них эффекторных функций. Таким образом, ДНК-вирусы типа поксвирусов, герпесвирусов и аденовирусов применяют разнообразные механизмы, позволяющие им увеличивать время эффективной репликации и распространения вирусных частиц. Кроме того, герпесвирусы дополнительно способны уклоняться от иммунной системы организма хозяина за счет индукции состояния латентности. Для в-герпесвирусов характерна медленная динамика репликации, а также ограниченный круг организмов, которые они могут поражать. Кроме того, им присуща тенденция устанавливать латентную персистенцию в гемопоэтических предшественниках, эпителиальных и железистых клетках. Цитомегаловирус человека обычно приводит к укрупнению инфицированной клетки с формированием так называемых «цитомегал», или гигантских клеток. Цитомегаловирус является повсеместно распространенным возбудителем, его носительство обнаруживается у 70—100 % здорового взрослого населения, при этом может отмечаться лишь субклиническое проявление инфекции. В то же время вирус может вызывать высокую заболеваемость и смертность у лиц с ослабленным иммунитетом. Такие типы клеток как фибробласты, гладкие миоциты, эндотелиальные клетки, эпителиоциты, моноциты и гранулоциты во время острой (литической) фазы инфекции могут подвергаться инфицированию. Инфицирование моноцитов приводит не к их лизису, а к формированию латентного персистирования. Интересно, что ЦМВЧ при любой активации иммунной системы может переходить из состояния латентности к активной фазе жизненного цикла. Механизмы уклонения вируса от иммунной атаки в целом могут быть разделены на три группы: 1) уклонение от распознавания компонентами гуморального иммунитета, например за счет изменения иммунодоминантных эпитопов; 2) препятствование клеточному иммунитету, например за счет подавления презентации вирусных пептидов, а также подавления активности НК-клеток; 3) подавление реализации эффекторных функций, например экспрессии цитокинов, а также апоптоза инфицированных клеток. В настоящее время описаны многообразные способы уклонения от иммунной атаки ЦМВЧ, в частности, инфицирование клеток миелоидного ростка. Если инфицирование дифференцированных макрофагов ведет к пермиссивной инфекции и появлению нового вирусного поколения, то инфицирование моноцитов ограничивается лишь экспрессией генов самой ранней фазы. Инфицирование какого-либо типа клеток, приходящих в ткани во время неактивной фазы инфекции, является идеальным временем для уклонения от атаки иммунной системой. Когда Т-клетки активированы, например во время аллогенного ответа или воспалительной реакции, они производят ИФНу и ФНОа, важные для реактивации латентного ЦМВЧ. Важно, что ИФНу и ФНОа специфически индуцируют дифференцировку моноцитов в макрофаги, крайне важных для прогрессирования ЦМВИ. При этом ЦМВЧ резистентен к противовирусным эффектам этих цитокинов. Как следствие реактивации и подавления репликативного цикла, вирусные белки подвергаются презентации, где ведущую роль приобретают уже другие способы уклонения от иммунного распознавания. Кроме того, у ЦМВЧ имеются возможности скрыть от иммунной системы ранее синтезированные белки, например за счет белка рр65. Важно, что рр65 ЦМВЧ входит в состав вирусной частицы и после инфицирования начинает проявлять свои биологические эффекты, обеспечивая таким образом нераспознавание иммунной системой ЦМВЧ. Белок gpUS3 ЦМВЧ препятствует выходу главного комплекса гистосовместимости (МНС) I класса (MHC-I) молекул из эндоплазматического ретикулума (ЭПР), транспорт пептидов в ЭПР подавляется gpUS6, a gpUS2 и gpUSll приводят к транслокации MHC-I молекул обратно в цитозоль и к последующей деградации протеасомой. Поскольку исчезновение молекул MHC-I с поверхности клеток ведет к активации НК-клеток, вирусу необходимо дополнительно способствовать уклонению инфицированной клетки от атаки НК-клетки. В частности, gpUL40 ЦМВЧ и ИЛ-10, соответственно, индуцируют экспрессию неклассических MHC-I молекул, HLA-E и HLA-G. Пока неясно, может ли к этому же привести экспрессия UL18, вирусного гомолога MHC-I молекул, поскольку низкая восприимчивость ЦМВЧ-инфицированных эндотелиальных клеток и макрофагов к лизису НК-клетками не зависит от подавления экспрессии HLA-I молекул и UL18. Более того, ЦМВЧ может подавлять один из центральных вариантов активации НК-клеток с участием HKG2D за счет экспрессии UL16. Помимо CD8+ Т-клеток, важная роль принадлежит и CD4+ Т-клеткам, необходимым для полной активации CD8+ Т-клеток и для продукции противовирусных антител В-клетками. Вирусные белки также могут препятствовать этому звену иммунного ответа, например, экспрессия MHC-II белков подавляется при экспрессии US2 ЦМВЧ, приводящего к деградации двух основных белков МНС-II-зависимой презентации антигенов. Кроме того, в инфицированных клетках возрастает экспрессия FcR молекул, что приводит к элиминации вирусспецифических антител. Помимо этого, вирус может изменять строение собственных антигенных детерминант, что позволяет ему избежать элиминации с участием гуморального иммунного ответа. Наконец, ЦМВЧ кодирует четыре гомолога рецепторов, сцепленных с G-белками: UL33, UL78, US27, US28, которые могут инактивировать хемокины, подавляя таким образом дальнейшее воспаление в области вирусной инфекции. Все указанные стратегии могут и будут использоваться вирусом для производства нового вирусного поколения и его распространения на других восприимчивых людей. И хотя вирус на один шаг всегда опережает защитные механизмы организма хозяина, сосуществование с вирусом может вызвать эволюцию его иммунной системы. Например, можно полагать, что НК-клетки возникли для того, чтобы избирательно элиминировать вирус-инфицированные и опухолевые клетки, лишенные экспрессии MHC-I молекул. Таким образом, изучение механизмов индукции иммуносупрессии, иными словами, уклонения от иммунного надзора, поможет понять аспекты эволюции разных звеньев иммунной системы и тем самым способствовать улучшению профилактики и лечения вирусных инфекций. На фоне инфекции ЦМВЧ может развиваться инфицирование другими видами вирусов или бактериями, т. е. суперинфекция. Считается, что у лиц со СПИДом оппортунистические инфекции, например ЦМВЧ и Pneumocystis carinii, развиваются вследствие выраженного поражения иммунной системы самим ВИЧ. С другой стороны, гомолог хемокинового рецептора ЦМВЧ US28 может способствовать проникновению ВИЧ-1 в клетки, уже инфицированные ЦМВЧ. Более того, ВГЧ-6 инфицирует В-клетки, латентно инфицированные ВЭБ, более эффективно, чем ВЭБ-негативные. Инфекция ВГЧ-6 ряда ВЭБ-позитивных В-клеточных линий может индуцировать литический репликативный цикл ВЭБ. Вирус ВГЧ-6А также индуцирует экспрессию CD4 молекулы на CD3+ CD4~CD8+ Т-лимфоцитах, что делает их более чувствительными к инфицированию ВИЧ-1. Другим примером может быть усиленная экспрессия РНК-вируса папилломы человека (ВПЧ) Е6 и Е7, что было показано в ВГЧ-6-инфицированных, ВПЧ-трансформированных эпителиальных клетках цервикального канала. Подобное взаимовлияние наблюдается и между вирусами одного вида. Например, инфицирование ПМНК здорового человека ВГЧ-7 приводит к реактивации латентного ВГЧ-6, что может превзойти количество исходного ВГЧ-7. Таким образом, вирусы различных видов могут кооперироваться между собой с целью взаимного выживания обоих вирусов в организме человека. Большое значение в противовирусной защите организма придается системе интерферонов (ИФН). Для хронических вирусных инфекций (герпеса, гепатита В), а также заболеваний невирусной природы характерно выраженное подавление интерфероногенеза. При этом более значительно продукция ИФН подавлена у больных с тяжелым течением хронического заболевания. Фоновые показатели сывороточного ИФН сочетаются с резко угнетенной способностью иммуноцитов синтезировать ИФНа и ИФНу. Таким образом, система ИФН осуществляет не только первую линию защиты организма от инфекций (когда иммунная система еще не успевает отреагировать), но и участвует в дальнейших (уже иммунных) процессах уничтожения чужеродных объектов. Если иммунная система отвечает за неизменность белкового состава организма, то система ИФН — за поддержание генетического гомеостаза, т. е. за сохранение постоянства состава организма на уровне генома. С целью объективной оценки состояния системы ИФН в клинической практике используют понятие «интерферонового статуса», который включает ряд показателей: 1) содержание различных типов ИФН в сыворотках крови (сИФН), т. е. количественное определение содержания ИФН, уже присутствующего в организме и выполняющего защитные и регуляторные функции; 2) способность лейкоцитов крови к продукции различных типов ИФН (индукция ИФН, или интерфероновая реакция лейкоцитов). Отмечено, что выраженная спонтанная продукция ИФН может показывать наличие в организме таких индукторов ИФН, как реплицирующиеся вирусы, хламидии и др. Следует подчеркнуть, что достаточно полную картину системы ИФН может дать только указанная комбинация показателей, так как каждый из них в отдельности не дает четкого представления о происходящих процессах в организме. В табл. 9 приводятся основные возможные варианты ИФН-статуса у больных с различными формами инфекционного процесса и возможные способы терапии. При обследовании здоровых людей в сыворотке крови определяются очень низкие количества циркулирующего ИФН при высокой способности лейкоцитов продуцировать ИФН in vitro. Рекомендуется наряду с абсолютными значениями выражать результаты исследований в процентах от нормы. При патологических состояниях изменяется соотношение циркулирующего и индуцированного ИФН, а также утрачивается способность лейкоцитов периферической крови продуцировать ИФНа/Р и ИФНу. Анализируя изменения в ИФН-статусе на примере вирусных инфекций (см. табл. 9), следует отметить, что состояние системы ИФН отражает динамику развития заболевания. Острая вирусная инфекция сопровождается повышением содержания общего сывороточного ИФН на фоне снижающейся способности лейкоцитов к продукции разных типов ИФН, что отражает нормальную реакцию организма на активную вирусную инфекцию. В этой ситуации применение индукторов ИФН окажется малоэффективным. Целесообразно назначение 1—2 курсов современных препаратов ИФН (например, виферона — реаферона в сочетании с антиоксидантами), а в период реконвалесценции показано использование индукторов ИФН (амиксина, изопринозина, циклоферона и др.). Тяжелое течение инфекции характеризуется выраженным дисбалансом системы ИФН: показатели сывороточного ИФН > 35 МЕ/мл при резко сниженной способности лейкоцитов к синтезу ИФНа/р (< 60 МЕ/мл) и ИФНу (< 30 МЕ/мл). Показана заместительная ИФН-терапия в сочетании с этиотропной и патогенетической терапией. При хронической вирусной инфекции (вирусно-бактериальных, персистирующих) на фоне снижения уровня сИФН отмечается более высокая способность лейкоцитов к продукции индуцированного ИФНа/в и ИФНу по сравнению с острыми вирусными заболеваниями (см. табл. 9). В этих случаях рекомендуют этиотропную терапию в сочетании с ИФН иммуномодуляторами. Повышение продукции ИФНа/р и ИФНу является показанием для применения индукторов ИФН и классических иммуномодуляторов. В случае выраженной депрессии активности системы ИФН и иммунной системы (рецидив хронической инфекции, активная репродукция вируса) можно выявить углубление дисбаланса системы ИФН: существенное снижение сИФН сочетается с резким понижением индуцированной продукции лейкоцитами ИФНа/в и ИФНу до 5—10 % от уровня нормы. Система ИФН не в состоянии осуществлять свои защитные функции и адекватно реагировать на стимуляцию. Возможна генерализация инфекционного процесса. При этом показана заместительная ИФН-терапия, которая может предшествовать назначению антибиотиков и химиопрепаратов, в дальнейшем с ними сочетаясь. По мнению Е. Т. Сухих, общая схема иммунного ответа на герпетическую инфекцию может быть представлена следующим образом. Иммунный ответ организма человека на вирусную инфекцию делится на две фазы: фазу локализации вируса на ограниченной анатомической площади и фазу позднего специфического воздействия, в течение которой локализованная инфекция удаляется. В Санкт-Петербурге проводилось комплексное иммунологическое обследование 148 больных ГГ, обусловленным ВПГ. У 42 % больных отмечалось тяжелое течение ГГ (рецидив не менее 1 раза в месяц), 33 % имели среднетяжелую форму (1 рецидив в 2—3 мес.) и 25 % — латентную форму инфекции (табл. 10, табл. 11). В периферической крови определялось количество субпопуляций Т-лимфоцитов (CD3, CD4, CD8 и CD22), пролиферативная активность лимфоцитов под действием T- и В-клеточных митогенов в реакции бласттрансформации лимфоцитов, активность естественных киллеров (EK) и антителозависимая цитотоксичность лимфоцитов. Исследовались фагоцитарная и метаболическая активность лейкоцитов по спонтанному и индуцированному тесту восстановления нитросинего тетразолия (НСТ-тест), уровень катионных белков лактоферрина и миелопероксидазы, показатели уровня церулоплазмина, трансферрина, иммуноглобулинов и циркулирующих иммунных комплексов. Определялся уровень ИЛ-1 и ИЛ-2, проводилось HLA-фенотипирование сывороток 45 больных генитальным герпесом. Доказано, что при ГГ снижено общее число CD3 и CD4 клеток и иммунорегуляторный индекс (ИРИ), угнетена активность EK и антителозависимая клеточная цитотоксичность, а также способность лимфоцитов к синтезу эндогенного интерферона. Следует отметить, что при РГГ естественные киллеры обеспечивают лизис клеток, инфицированных ВПГ, и являются в комплексе с ИФН основным фактором антивирусной резистентности. В то же время РГГ может рассматриваться как пример диссоциации функционирования систем естественной цитотоксичности и ИФН, обусловливающей, по-видимому, известные трудности в поиске рациональных подходов к коррекции иммунодефицита у больных РГГ. Выявленные изменения окислительно-восстановительного потенциала нейтрофилов характерны для больных со среднетяжелым и тяжелым течением рецидивирующего герпеса. Они зарегистрированы в фазе рецидива; в фазе ремиссии наблюдалась положительная динамика изученных показателей, однако они оставались ниже нормы. Усиление окислительно-восстановительного потенциала нейтрофилов коррелировало с повышенными значениями ЦИК в фазе обострения. Острая фаза ГИ сопровождается падением суммарного содержания катионных белков, что может свидетельствовать об интенсивной секреции нейтрофилами крови и активном вовлечении этих клеток в систему защитных реакций организма. По мере выздоровления больного повышается сывороточный уровень катионных белков. В периоде рецидива отмечено повышение антиоксидантного потенциала сыворотки крови. Причем напряжение в функционировании антиоксидантной системы защиты организма сохраняется и в периоде ремиссии, что, по-видимому, обусловлено необходимостью инактивации повышенных концентраций активных форм кислорода. Следует отметить, что вирусы герпеса не только фиксируются на мембране лейкоцитов и моноцитов, но даже размножаются в лейкоцитах людей независимо от наличия или отсутствия у них антител к этому вирусу. Инфицированные моноциты в циркуляции при условии репликации вируса герпеса могут служить источником генерализации инфекции. Таким образом, при РГГ угнетены и разбалансированы системы T- и В-клеточного иммунитета. Вместе с тем наблюдается функциональная неполноценность системы неспецифической резистентности организма. У больных герпесом снижена продукция эндогенного ИФН, уменьшена активность натуральных киллеров и антителозависимая клеточная цитотоксичность, меньше абсолютное число и ниже активность Т-лимфоцитов (CD3+ и CD4+ клеток) и нейтрофилов, повышено количество иммунных комплексов. Выявленные нарушения в иммунном гомеостазе регистрируются в фазе рецидива и ремиссии заболевания, тем самым во многом предопределяя и объясняя развитие длительной персистенции ГB в организме с установлением рецидивирующего течения болезни. Вышеизложенные обстоятельства должны учитываться практическими врачами при лечении больных ГГ. Таким образом, формирование иммунитета при ГВИ является сложным и многокомпонентным процессом, в ходе которого клеточная кооперация может нарушаться на различных этапах. Так, например, активность макрофагов, характер вирусной инфекции и доставка вирусспецифического антигена В-лимфоцитам на индуктивной стадии герпеса определяет резистентность организма к этой инфекции. С другой стороны, решающее влияние на ГИ оказывает специфический клеточный иммунитет, опосредованный Т-лимфоцитами. Состояние клеточного иммунитета человека в значительной степени определяет характер течения ГИ, частоту и интенсивность рецидивов. Однако еще многое неизвестно в механизме клеточного иммунитета, например, что способствует или прерывает рецидивы инфекции. От продукции антител В-лимфоцитами и от взаимодействия Т-лимфоцитов с инфицированными клетками зависит развитие и состояние приобретенного иммунитета. Известно, что при нарушениях иммунного статуса ГИ развивается чаще и характеризуется более тяжелым течением, что связано с недостаточностью иммунитета или избыточной иммунной реакцией. Механизмы иммунопатологии при ГИ разнообразны и включают как ответ на персистирующий антиген, так и неадекватную регуляцию вирусспецифического иммунного ответа. Среди иммунопатологических состояний выделяют реакции, индуцированные иммуноглобулинами; иммунопатологию, вызванную иммунными комплексами и Т-лимфоцитами. Выраженность иммунопатологического компонента при ГИ, по-видимому, можно снизить путем воздействия на отдельные звенья иммунной системы. Герпесвирусы не только персистируют, но и репродуцируются в клетках иммунной системы, обусловливая гибель или снижение функциональной активности этих клеток, что способствует развитию вторичных иммунодефицитных состояний и вызывает поддержание длительной персистенции. Таким образом, возникает своеобразный «порочный круг». Показано, что у больных герпесом снижена продукция эндогенного интерферона, активность натуральных киллеров и антителозависимая клеточная цитотоксичность, уменьшено абсолютное число и снижена активность Т-лимфоцитов (CD3+ и CD4+ клеток) и нейтрофилов, повышено количество иммунных комплексов. В условиях ослабленного иммунологического контроля не только становится невозможной полная элиминация внутриклеточно расположенного вируса, но и создаются благоприятные условия для распространения вируса от клетки по межклеточным мостикам или экстрацеллюлярным путем. Следует отметить: выявленные нарушения в иммунном статусе сохраняются как в фазе рецидива, так и в фазе ремиссии, что необходимо учитывать при лечении больных ГИ. | |
|
| |
| Всего комментариев: 0 | |