10:49 Новые сведения об иммунопатогенезе герпесвирусных инфекций | |
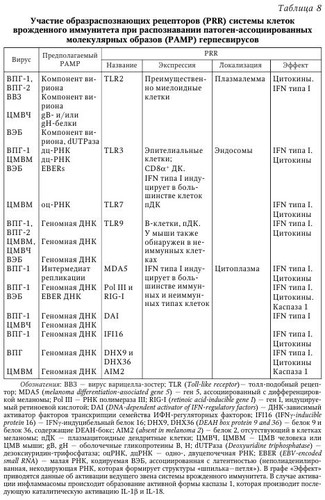
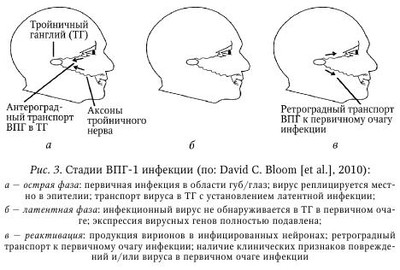
Литическая фаза инфекции. Несмотря на то что возбудители, принадлежащие к разным видам, имеют различное строение генома (вирусы, бактерии, простейшие), их первичное распознавание иммунной системой как носителей чужеродной биологической информации происходит благодаря наличию у них эволюционно консервативных структур, патоген-ассоциированных молекулярных образов (pathogen-associated molecular patterns, PAMPs). Рецепторы, которые представлены как в клетках иммунной системы, так и в неиммунных клетках организма, объединены в семейство образраспознающих рецепторов (pattern recognition receptors, PRRs). Более подробно представления о системе рецепторов PRR и PAMPs возбудителей представлены в руководстве по иммунобиологии а также в работе. Семейство PPR представлено различными белками, которые экспрессируются как на плазмалемме клеток, так и внутриклеточно (эндосомы, цитоплазма). После распознавания PAMPs рецепторы PPR запускают различные молекулярные каскады, которые приводят к активации различных звеньев системы врожденного иммунитета (продукция IFN типа I [IFNa и IFNp], продукция цитокинов, активация НК-клеток) (табл. 8). Одним из ключевых событий в индукции клеточного противовирусного иммунного ответа является распознавание антигена CD4+ и CD8+ Т-клетками. Поскольку такое распознавание происходит в ходе презентации антигена антиген-презентирующими клетками (АПК), возникает вопрос об их происхождении и анатомической локализации самого процесса. В зависимости от пути инфицирования распространение вируса может осуществляться несколькими путями. Однако они могут быть неодинаково эффективны по способности индуцировать иммунный ответ. Рассмотрим их на примере ВПГ-инфекции. 1. Перенос вируса с током лимфы в дренирующий ЛУ: инъекционный путь инфицирования ВПГ-1 (при вакцинации). Этот вирус может обнаруживаться в дренирующем ЛУ через 30 мин, тогда как после эпикутанного нанесения он обнаруживается через 2—8 ч. В дальнейшем происходит презентация антигена и активация специфических CD4+ и CD8+ Т-клеток. 2. Перенос вируса тканевыми ДК в дренирующий ЛУ для презентации антигена Т-клеткам. Инъекционный путь: благодаря крайне быстрой кинетике оттока лимфы мигрирующие ДК остаются незадействованными. Напротив, при эпикутанном нанесении ДК кожи обладают разной эффективностью к миграции в дренирующий ЛУ. В частности, именно ДК глубоких слоев кожи, расположенных в толще дермы, но не клетки Лангерганса внешнего эпидермального слоя, способны транспортировать антиген в ЛУ. Однако дермальные ДК сами не способны активировать CD8+ Т-клетки, что указывает на наличие другого типа АПК. В ходе мукозного/слизистого пути инфицирования (нанесение на слизистую влагалища) мигрирующие тканевые ДК играют ведущую роль в активации Т-клеток ЛУ. Отличия в роли типа ДК для активации Т-клеток в ЛУ при развитии эпикутанной и мукозной ВПГ-инфекции могут быть обусловлены существенно большим количеством чувствительных клеток в эпителии по сравнению с кожными покровами. 3. Резидентные ДК лимфоузлов производят кросс-презентацию вирусного антигена. Наконец, было установлено что при эпикутанном нанесении конечную активацию CD8+ Т-клеток в ЛУ осуществляют резидентные ДК лимфоузлов, что достигается при так называемом «переносе антигена». Данное явление возможно при двух обстоятельствах; поскольку мигрирующие ДК, инфицированные вирусом, могут погибать, то в ЛУ они фагоцитируются резидентными ДК, после чего вирусные антигены подвергаются кросс-презентации. С другой стороны, дермальные ДК также могут процессировать антиген, после чего комплекс MHC-I/пептид может также обнаруживаться на поверхности особых секреторных везикул, экзосом, которые активно выделяются ДК. В свою очередь, экзосомы могут захватываться местными ДК для последующей презентации предсуществующих процессированных комплексов MHC-I/пептид. Несмотря на это, важно иметь в виду, что в случае ВПГ-1 инфекции полноценная стимуляция CD8+ Т-клеток возможна, если ей предшествовала активация дендритными клетками Thl CD4+ Т-клеток. В случае мукозного/слизистого пути стимуляция со стороны резидентных ДК оказывает существенно меньшее значение. После того как в ходе острой фазы (фаза экспансии) инфекции вирусный антиген достигнет дренирующего ЛУ и пройдет стадии процессинга и презентации в ДК, он способен вызывать активацию антиген-специфических CD4+ и CD8+ Т-клеток. На основании различных моделей инфекционных заболеваний у мыши было показано, что данный процесс проходит ряд стадий. Рассмотрим их на примере мышей, инфицированных вирусом коровьей оспы (родственней вирусу кори): 1) инфицирование ткани (кожа); 2) миграция тканевых ДК с захваченным антигеном в дренирующий ЛУ; 3) презентация антигена Т-клетками; 4) пролиферация Т-клеток in situ; 5) усиление экспрессии на Т-клетках хоминг-рецепторов для миграции в инфицированную ткань (кожа); 6) миграция Т-клеток: а) в инфицированные ткани (кожа), б) в антиген-негативные ткани. Как видно из экспериментальных данных, в ответ на распознавание антигена Т-клетки проходят стадию клональной экспансии, что приводит к многократному увеличению количества Т-клеток эффекторов и Т-клеток памяти, которые и производят элиминацию инфицированных клеток-мишеней. Последние обладают способностью к длительному самоподдержанию в отсутствие антигена in vivo. После этого их пролиферативная активность подвергается ограничению, что, вероятно, обусловлено как физическими ограничениями (объем ЛУ), так и наличием доступных ДК, поскольку после активации Т-клетки, в особенности CD8+ Т-клетки, элиминируют ДК. Помимо экспансии, в ходе пролиферации запускается изменение фенотипа Т-клеток, что, в частности, видно по индукции на них хоминг-рецепторов для миграции в инфицированную ткань (специфичность хоминг-рецепторов модулируется ДК, дренирующими разные лимфоидные и паренхиматозные ткани, а также иными факторами). Благодаря этому, Т-клетки способны обеспечивать непосредственный тканеспецифический иммунный контроль против патогенов. Кроме того, появление их в незатронутых тканях предоставляет системную защиту для организма против возможной диссе-минации возбудителя и/или повторного контакта с ним. Одним из важных следствий развития протективного клеточного иммунитета является формирование долгоживущих CD4+ и CD8+ Т-клеток памяти. Наиболее наглядно данное правило отражено в применении вакцин (например, эпикутанное введение аттенуированного вируса коровьей оспы, вакцинации методом скарификации кожи успешно защищает человека от оспы, которая обычно развивается после интраназального или орофарингеального пути проникновения). Вместе с тем, системное введение вакцин (через кожные покровы, внутримышечно и т. д.) не всегда может достигать максимального профилактического (обусловлен формированием пула T-и В-клеток памяти) и терапевтического эффекта (обусловлен активацией преимущественно Т-клеток эффекторов), что может быть обусловлено особенностями иммунопатогенеза конкретного инфекционного процесса. Напротив, использование вакцин направленного действия, нацеленных на формирование местного тканевого иммунитета, также может иметь важное значение. Это обусловлено тем, что в ходе острой фазы иммунного процесса происходит активация Т-клеток-предшественников, склонных по-разному экспрессировать как хоминг-рецепторы для миграции в лимфоидные ткани (ЛУ, селезенка), так и в нелимфоидные органы. На этом основании выделяют по меньшей мере два вида Т-клеток памяти: Т-клетки «центральной памяти» (Т central memory, Tcm), преимущественно мигрирующие в лимфоидные ткани, и Т-клетки «эффекторной памяти» (T effector memory, Теm), которые главным образом обнаруживаются в паренхиматозных тканях. Оба типа Т-клеток памяти имеют разный поверхностный фенотип, а также склонность к продукции защитных факторов. В этой связи особого внимания заслуживает упоминание о новом типе резидентных Т-клеток памяти (Г resident memory, Trm), представленных, как и Tem, в нелимфоидных тканях, однако лишенных способности к миграции. Первое упоминание о них было получено на мышиной модели ВПГ-инфекции кожи, когда показали, что после установления контроля за репликацией вируса во время острой фазы ВПГ-инфекции CD4+ и CD8+ Trm длительно обнаруживались как в эпидермисе, так и в сенсорных ганглиях на протяжении латентной фазы заболевания. Важно отметить, что аналогичные долгоживущие CD8+ Т-клетки у человека также обнаружены внутри сенсорных ганглиев (тройничный ганглий) в непосредственной близости к латентно инфицированным нейронам. Более того, CD8+ Trm не обладали способностью к миграции за пределы нелимфоидных тканей, не подвергались смешиванию с пулом рециркулирующих Т-клеток памяти, обладали медленной гомеостатической пролиферативной активностью. Пожалуй, самое уникальное открытие заключалось в том, что CD8+ Trm обладали высокой протективной активностью. Вероятно, ВПГ-специфичные CD8+ Trm в эпидермисе и сенсорных ганглиях могут служить самой первой линией контроля за реактивированным вирусом. Аналогичные CD8+ Trm также недавно были описаны в тонком кишечнике и головном мозге. Одной из интересных особенностей фенотипа CD8+ Trm в этих разных нелимфоидных тканях является экспрессия у них интегрина CD103, который более типичен для клеток, мигрирующих в кишечник, и в меньшей степени — в кожные покровы. Возможно, что CD8+ Trm (и CD4+ Trm) представляют ранее неидентифицированный тип Т-клеток памяти, который может иметь важное значение в поддержании иммунного гомеостаза в нелимфоидных тканях организма. Латентная фаза инфекции. Латентное состояние вирусов герпеса характеризуется практически полным отсутствием репликации вирусных генов и синтеза белков, выделения вирионов, а также персистенцией и обратимостью. При этом вирусный геном обнаруживается в ядре и цитоплазме в виде эписом (неинтегрирован в геном клетки, ассоциирован с нуклеосомами), как показано для большинства TB человека, так и в интегрированном в хромосомы виде (ВЭБ, ВГЧ-6). Механизмы, приводящие к реактивации транскрипции вирусного генома, изучены недостаточно полно. Однако в отношении ряда вирусов семейства герпесов, имеющих особое эпидемиологическое значение, за последнее время были получены важные данные, позволяющие лучше понимать молекулярные особенности перехода вируса из состояния латентности в фазу реактивации. Неудивительно, что, находясь в состоянии латентности, вирус практически полностью «уходит» из-под иммунного надзора. Поэтому состояние латентности является ключевым событием в формировании персистентных герпесвирусных заболеваний. Наибольший прогресс в изучении состояния латентности был достигнут при изучении ВПГ-1, ВЭБ и ВГЧ-8, что и будет рассмотрено далее. ВПГ-1. Поддержание ВПГ-1 в латентном состоянии представляет собой сложный процесс, с задействованием различных регуляторных механизмов. Во время спорадической спонтанной реактивации ВПГ-1 в латентно инфицированых нейронах сенсорных ганглиев (см. табл. 8) происходит выделение вируса в кровоток, что приводит к повторному инфицированию эпителиальных тканей организма (фаза продуктивной, или литической, репликации; см. рис. 2). Это может сопровождаться появлением клинической картины заболевания в очаге первичного инфицирования (область гениталий, эпителий и кожа губ и ротовой полости, роговица глаз), нередко имеющего более тяжелое течение. Кроме того, реактивация вируса часто сопровождается асимптомным течением, когда вирус может выделяться и инфицировать других лиц. Латентное состояние ВПГ-1 в нейронах может поддерживаться пожизненно, характеризуется обнаружением в ядрах вирусной РНК LAT (latency-associated transcript — транскрипт, ассоциированный с латентностью) и полным отсутствием экспрессии генов литического цикла. Как уже отмечалось, латентное состояние вируса является обратимым, а пусковым механизмом к реактивации ВПГ-1 могут быть УФО-облучение, лихорадка, стресс, сниженный иммунный статус организма, повреждение нервов, а также различные инфекции. Как и в случае первичной инфекции ВПГ-1, особое значение для купирования рецидива имеют CD8+ Т-клетки. На модели ВПГ-1 инфекции у мыши было показано, что CD8+ Т-клетки могут полностью подавлять реактивацию вируса, что частично опосредовано продукцией ими IFN-y (некоторые нейроны рефрактерны к его действию). Кроме того, для иммунного контроля важен был также продукт литических гранул Т-клеток, гранзим В. В частности, было показано, что при распознавании на нейронах вирусных антигенов в комплексе с MHC-I молекулами CD8+ Т-клетки секретировали в сторону нейронов литические гранулы с гранзимом В, что, однако, не сопровождалось гибелью нейронов. Установлено, что гранзим В расщеплял продукт очень раннего гена ВПГ-1 под названием ICP4 (infected cell protein 4 — белок 4 инфицированной клетки), который во время литической фазы инфекции обеспечивает транскрипцию ранних и поздних генов вируса. Другие компоненты литических гранул, гранзим А и перфорины, также вносят свой вклад в поддержание ВПГ-1 в состоянии латентности в инфицированных нейронах. Поскольку во время реактивации ВПГ-1 в нейронах специфические CD8+ Т-клетки способны распознавать вирусные антигены в течение первых часов, то секреция ими гранзима В с последующей деградацией ICP4 приводит к подавлению транскрипции вирусных генов на самых ранних этапах его реактивации. Помимо ICP4, при реактивации ВПГ-1 из латентного состояния в ряде биоптатов также обнаруживается другой транскрипт очень ранних генов, ICPO. Наконец, в недавней работе было показано, что устойчивость к апоптозу, вызванному гранзимом В, прямо ассоциирована с обнаружением в нейронах вирусной РНК под названием LAT, наиболее представленного транскрипта ВПГ-1, который обнаруживается на всем протяжении состояния латентности в их ядрах. Также полагают, что LAT может участвовать в поддержании промоторов генов литического цикла в обратимом репрессированном состоянии. Таким образом, экспрессия в нейронах вирусного антиапоптозного фактора LAT во время реактивации латентного ВПГ-1, эволюционно возникшая для избегания иммунной атаки (подавление апоптоза, вызванного гранзимом В), позволяет защищать нейроны от лизиса. Одновременно с этим, гранзим В CD8 Т-клеток (и НК-клеток) производит деградацию вирусного белка ICP4, тем самым препятствуя транскрипции полного генома вируса, что приводит к поддержанию ВПГ-1 в состоянии латентности. Важно отметить, что состояние латентности ВПГ-1 прямо ассоциировано с поддержанием нормального физиологического статуса в самих нейронах. В частности, оно обеспечивается за счет постоянной базальной передачи сигналов от NGF (nerve growth factor — фактор роста нервов), что определяет длительность поддержания ВПГ-1 в состоянии латентности. Важно отметить, что NGF присоединяется к своему рецептору в области окончаний аксонов и затем подвергается ретроградному транспорту к телу нейрона. Поэтому повреждение аксонов (травма, ризотомия тройничного нерва) прерывает данный путь, что приводит к исчезновению передачи сигналов от NGF и, как следствие, реактивации ВПГ-1. Вероятно, благодаря «противорецидивному» эффекту NGF можно объяснить эффективность его применения в виде глазных капель при лечении герпетического кератита, устойчивого к лечению ацикловиром. Очевидно, при таком методе назначения NGF может достигать аксонов тройничного нерва, расположенных в области глазного яблока, и далее индуцировать сигналы, приводящие к подавлению литической репликации ВПГ-1 (рис. 3). Обычно инфицирование человека ВПГ-1 происходит в области слизистой оболочки губ или глаз. В ходе первичной острой инфекции вирус реплицируется местно в слизистом эпителии, после чего он способен достигать окончаний чувствительных нервов, расположенных под кожным покровом. Затем вирус достигает тел нейронов в тройничном ганглии, где в ряде клеток запускает либо свою репликацию, либо входит в латентную стадию. Во время латентной фазы вирус находится в неактивном состоянии в пределах тройничного ганглия, что сопровождается отсутствием обнаружения инфекционного вируса наряду с полным подавлением экспрессии вирусных генов, за исключением LAT. Стрессовые ситуации приводят к периодам реактивации вируса, в ходе которых в некоторых нейронах отмечается транскрипция генов литической фазы вирусного цикла и репликация вирусной ДНК. В результате происходит сборка новых вирионов, которые подвергаются обратному транспорту по аксонам к первичному очагу инфекции. В итоге в очаге исходного инфицирования снова обнаруживается инфекционный вирус, что в ряде случаев может сопровождаться появлением клинических повреждений, таких как herpes labialis. В силу того что для изучения состояния латентности подсемейства а- и в-ГВ практически не разработаны модели на культивируемых клеточных линиях (только у живых людей и животных), большие успехи в изучении этого феномена были достигнуты для у-ГВ, ВЭБ и ВГЧ-8. Несмотря на то что у-ГВ человека имеют существенные различия в строении генов, для них характерен ряд особенностей, которые они реализуют при установлении состояния латентности. В частности, ВЭБ и ВГЧ-8 имеют линейную двойную цепочку ДНК, которая при инфицировании клеток проникает в ядро и замыкается в кольцо, формируя плазмиду. ДНК в составе вириона обычно не содержит гистонов, однако после образования плазмиды она образует структуры по типу хроматина. В состоянии латентности лишь небольшое число генов, отвечающих за репликацию вирусного генома, остается в активном состоянии. Некоторые из активных генов влияют на различные молекулярные клеточные каскады, в частности на активность сигналов через фактор транскрипции NF-kB, имеющий особое значение для поддержания латентности. Интересно, что, несмотря на наличие указанных общих черт, белки обоих вирусов не имеют сколько-нибудь выраженной структурной гомологии. Как было отмечено, состояние латентности является обратимым. Поэтому при определенных условиях возможен запуск программы литической репликации. В отличие от генов латентности, гены литического цикла имеют высокую степень консерватизма между ВЭБ и ВГЧ-8, где литическая реактивация контролируется одним (или более) главным регулятором транскрипции. Экспрессия таких генов индукторов литической фазы подавлена в состоянии латентности, но подвергается дерепрессии при литической реактивации. При этом активаторы запускают экспрессию других генов, что в итоге приводит к началу литического цикла. ВЭБ. Первым представителем семейства у-ГВ человека был открыт ВЭБ, что установлено при изучении В-клеточных линий, полученных от пациентов с африканской лимфомой Беркитта. В настоящее время ВЭБ также ассоциирован с разными лимфопролиферативными заболеваниями, лимфомами, а также с нелимфоидными опухолями. Первичной мишенью вируса являются В-клетки, причем, как показано in vitro, после инфицирования состояние латентности развивается по умолчанию. Одним из важных следствий инфицирования В-клеток является их иммортализация, в которой главную роль играют вирусные белки EBNA-1, EBNA-2, EBNA-3a, EBNA-Зс, EBNA-LP и LMP-1 (ядерные антигены вируса Эпстайна — Барр; мембранные белки, ассоциированные с латентностью). В зависимости от обнаружения в иммортализованных В-клеточных линиях разных генов ВЭБ различают три типа латентности: — тип I — наличие EBNA-1 (обнаружен при лимфоме Беркитта); — тип II — наличие EBNA-1, LMP-1 и/или LMP-2 (обнаружен при назофарингеальной карциноме и ВЭБ-позитивных лимфомах Ходжкина); — тип III — наличие EBNA-1, LMP-1 и/или LMP-2, а также других вирусных белков. В состоянии латентности ВЭБ в периферической крови обнаруживается исключительно в покоящихся В-клетках памяти. Особенность В-клеток памяти заключается в том, что они способны диссеминировать в разные ткани организма (распространение ВЭБ), а также быстро пролиферировать в ответ на присутствие антигена (увеличение популяции ВЭБ). Кроме того, В-клетки памяти могут пожизненно существовать в организме и не подвергаться иммунной атаке. На основании исследований биоптатов нёбных миндалин серопозитивных пациентов было установлено, что ВЭБ обнаруживается в «наивных» В-клетках (не контактировавших с антигеном) с лимфобластным фенотипом (тип III латентности), В-клетках зародышевых центров (тип II латентности), в пролиферируюших В-клетках памяти (тип I латентности), а также в плазмацитах (с признаками литического цикла ВЭБ). На первом этапе вирус инфицирует «наивные» В-клетки, что приводит к появлению активированных лимфобластов, имеющих фенотип антиген-активированных лимфобластов. Передача генома ВЭБ дочерним В-клеткам во время их деления осуществляется за счет белка EBNA-1, который производит прикрепление вирусной эписомы к митотическим хромосомам (ВЭБ редко интегрируется в геном клетки). Однако, это более характерно для ВГЧ-6А, ВГЧ-6В и ВГЧ-7 за счет наличия у них «теломерных повторов» (ТМП), которые идентичны последовательности теломер клеток. На втором этапе некоторые из них становятся В-клетками зародышевых центров, в которых экспрессируется белок LMP-1, способный проводить сигналы, мимикрирующие сигналы от CD4+ Т-хелперов (в частности, через CD40). Также LMP-I активирует клеточный фактор транскрипции NF-кВ, что подавляет переход от состояния латентности к литическому циклу вируса. Поверхностная экспрессия вирусного белка LMP-2a обеспечивает проведение сигналов для выживания, которые в нормальных В-клетках запускаются через В-клеточный рецептор (BCR). Наконец, после завершения прохождения через зародышевый центр В-клетки формируют пул В-клеток памяти и плазмацитов. Затем В-клетки покидают лимфоидную ткань, переносятся с током крови в разные ткани организма и прекращают делиться. ВГЧ-8. Как известно, ВГЧ-8 был исходно выделен у пациентов с саркомой Капоши из инфицированного эндотелия сосудов. Недавно было показано: ВГЧ-8 способен нарушать программу дифференцировки эндотелия лимфатических сосудов, что может лежать в основе их онкогенеза. Позже было установлено, что вирус обладает также лимфотропизмом, что позволило впоследствии доказать его этиологическую связь с развитием первичной выпотной лимфомы (ПВЛ) и многоочаговой болезни Кастлемана (МБК), которые развиваются при инфицировании В-клеток. Согласно последним данным, можно предполагать, что при передаче со слюной ВГЧ-8 инфицирует исключительно IgM+ AC В-клетки субэпителиальной области нёбных миндалин. Более того, в отличие от ранее высказывавшихся гипотез, такие В-клетки являются не «наивными» В-лимфоцитами, а принадлежат в особому типу IgM+ В-клеток памяти. Важно отметить что ВГЧ-8, в отличие от ВЭБ, не приводит к иммортализации В-клеток. Как и у ВЭБ, после проникновения в ядро В-клетки геном ВГЧ-8 замыкается в кольцо и образует плазмиду. При ПВЛ обнаружено, что состояние латентности вируса поддерживается на постоянном уровне и составляет 97—99 %. В ходе изучения В-клеток пациентов с ПВЛ было обнаружено, что в состоянии латентности происходит трансляция целого ряда вирусных генов, кодируемых тремя разными областями вирусной ДНК: 1) LANA (latency-associated nuclear antigen — ядерный антиген, ассоциированный с латентностью), v-циклин, v-FLIP, а также гены семейства kaposin; 2) LANA-2/V-IRF3 (подавляет синтез IFN типа I; обнаружен при ПВЛ, но не при саркоме Капоши): 3) ген Kl: его экспрессия находится на крайне низком уровне, но резко повышается в ходе литического цикла. Сигналы от белка K1 мимикрируют сигналы от BCR аналогично белку LMP-2 из ВЭБ. Передача генома ВГЧ-8 дочерним В-клеткам осуществляется во время их деления за счет белка LANА, который действует аналогично EBNA-1 ВЭБ. Для поддержания ВГЧ-8 в латентном состоянии большое значение имеет белок v-FLIP, способный активировать клеточный NF-kB, который, как и LMP-1 ВЭБ, подавляет запуск литического цикла вируса. Интересно, что одним из механизмов контроля вирусного цикла может быть недавно описанный нецитолитический способ, опосредованный активированными CD4+ Т-клетками. Показано, что репликация KSHV (ВГЧ-8) в инфицированных первичных В-клетках миндалин чрезвычайно эффективно подавляется активированными CD4+ Т-клетками (но не CD8+ Т-клетками, и крайне умеренно В-клетками) с задействованием неидентифицированных ингибиторов и не зависит от распознавания комплекса МНС-П/пеп-тид. Данный способ позволяет предупреждать спонтанную реактивацию литического цикла вируса, а также поддерживать вирус в латентном состоянии. В дальнейших экспериментах будет интересно выявить, какие подтипы CD4+ Т-клеток обладают наибольшей ингибиторной активностью (Th1, Th2, Th9, Treg, Tr1 и др.) Реактивация ВЭБ и ВГЧ-8, сопровождаемая переходом латентного состояния к литической репликации, начинается с экспрессии очень ранних генов, кодирующих так называемый активатор репликации и транскрипции (BRLF1 для ВЭБ и продукт открытой рамки считывания-50 для ВГЧ-8). Важно, что in vivo запуск этих ключевых белков осуществляется в ответ на различные цитокины и иные факторы, индуцирующие дифференцировку В-клеток (например, через репрессор транскрипции Blimp-1 с последующей индукцией фактора транскрипции XBP-Is). | |
|
| |
| Всего комментариев: 0 | |