11:47 Перспективы терапии герпесвирусных инфекций у взрослых и детей | |
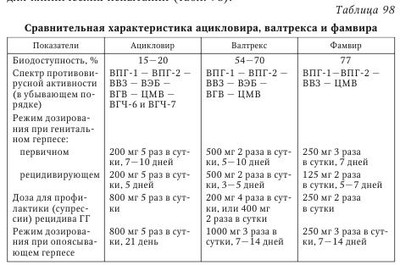
Среди большого числа препаратов, разрабатываемых для лечения ГВИ, лишь немногие достигли стадии клинического испытания. Основной прорыв в достижении антивирусной эффективности и безопасности препаратов произошел более 30 лет назад с открытием ацикловира, который продолжает оставаться важным и надежным противовирусным средством. Соединение обладает эффективностью в отношении ВПГ и ВОГ, а также зарекомендовал себя в клинической практике как крайне безопасное лекарственное средство. До появления АЦ применение таких препаратов, как видарабин, идоксиуридин и а-интерферон, вызывало проблемы, обусловленные их непостоянными антивирусными эффектами у людей, а также выраженной токсичностью при системном назначении. Открытие же АЦ явилось революционным достижением, а сам он теперь представляет собой первое поколение эффективных противогерпетических препаратов. Важно отметить два важных свойства АЦ — «игольчатость» механизма действия и крайне низкую токсичность. Несмотря на свою эффективность и безопасность, АЦ имеет ряд признаков, ограничивающих его клиническое применение. К ним относятся: умеренная in vitro активность против некоторых ГВ и плохое всасывание при пероральном приеме. В стадии клинической разработки находятся несколько новых противовирусных препаратов, разработанных для применения при ВПГ- и ВОГ-инфекциях и преодоления указанных недостатков АЦВ, но сохраняющих высокую степень безопасности и переносимости. Более того, соединения с анти-ЦМВ активностью, лишенные токсичности двух применяемых в настоящее время лекарств — ганцикловира и фоскарнета для внутривенного введения — могут также представлять собой важное достижение. Необходимо упомянуть о двух основных подходах, которые были применены для решения отмеченных проблем. Первый подход был нацелен на улучшение нуклеотидной структуры препаратов для достижения более высокой биоусвояемости, внутриклеточной фармакокинетики и противовирусной активности. Ранее были суммированы механизмы действия противовирусных соединений, воздействующих на синтез вирусной ДНК. Второй подход состоял в создании новых химических структур, которые обладают определенными механизмами действия для усовершенствования in vitro противогерпетической активности препаратов. Ниже предлагается обсуждение новых противогерпетических препаратов, которые были допущены для клинических испытаний (табл. 98). Фамцикловир/пенцикловир. Подобно АЦ и ганцикловиру, пенцикловир (ПЦВ) также является ациклическим аналогом гуанозина, способного подавлять синтез вирусной ДНК. Несмотря на проявление активности при внутривенном применении, ПЦВ крайне плохо всасывается при пероральном приеме. Диацетат пенцикловира, фамцикловир (ФЦВ), всасывается в тонком кишечнике и быстро превращается в стенке кишечника и в печени в активное соединение — пенцикловир. После перорального приема ФЦВ биоусвояемость ПЦВ составляет около 77 %. ПЦВ не метаболизируется, а выводится из организма в неизмененной форме с мочой. Период полужизни в плазме для антивирусных нуклеозидов в основном совпадает с таковыми для ПЦВ и АЦ (2,5 ч). В отношении механизма действия между ПЦВ и АЦ существуют некоторые качественные различия, касающиеся динамики их фосфорилирования, стабильности и концентрации трифосфатных производных, а также аффинности к вДНК полимеразе. ПЦВ легко проникает как в вирусинфицированные, так и в непораженные клетки. Однако противогерпесвирусная селективность ПЦВ основывается на его быстром фосфорилировании с образованием только в пораженных клетках активной формы — ПЦВ-трифосфата (ПЦВ-ТФ). Вирусная TK определяет протекание начальной скорость-лимитирующей реакции фосфорилирования с образованием ПЦВ-монофосфата; образование трифосфата уже осуществляется клеточными ферментами. Перевод АЦ в АЦ-ТФ происходит по аналогичной схеме и обладает подобной селективностью, однако уместно упомянуть о различиях в скорости фосфорилирования и во внутриклеточной стабильности нуклеозид-трифосфатов, характерных для ПЦВ и АЦ. По сравнению с АЦ, ПЦВ преимущественно поглощается и фосфорилируется именно ВПГ- и ВВЗ-инфицированными клетками. К тому же, ПЦВ-ТФ обладает крайне длительным внутриклеточным периодом полужизни в инфицированных клетках (7—20 ч против 0,7—1 ч для АЦ-ТФ). Ho по сравнению с АЦ-ТФ для подавления ВПГ-ДНК полимеразы требуются более высокие концентрации ПЦВ-ТФ. ПЦВ и АЦ имеют одинаковый спектр противогерпесвирусной активности и в одинаковых концентрациях вызывают 50 % подавление вирусной репликации (EC50) лабораторного и дикого штаммов ВПГ и ВВЗ. ПЦВ имеет ограниченную активность против ЦМВ, при этом сохраняя хорошую активность против ВЭБ. Подавляющее большинство ацикловиррезистентных ВПГ- и ВВЗ-клинических изолятов должны были быть также перекрестно устойчивы и к ПЦВ. Несмотря на это, явление перекрестной резистентности проявлялось не всегда, поскольку были описаны такие ацикловиррезистентные штаммы, TK и ДНК-полимераза которых содержали мутации, при этом оставаясь полностью чувствительными к ПЦВ. В отношении ТК-штаммов ПЦВ обладал большей активностью по сравнению с АЦ, хотя и при более высоких значениях EC50. Фамцикловир с успехом использовался при лечении 420 больных ОГ в дозах по 500 и 750 мг 3 раза в сутки в первые 72 ч от появления высыпаний. Получен положительный эффект по сравнению с плацебо. Более того, длительность ПГН уменьшалась со 128 дней в группе с плацебо до 62 и 55 дней в группах, где назначали препарат по 500 и 750 мг соответственно. У пациентов старшей возрастной группы, имеющих риск развития ПГН, наблюдался даже более выраженный терапевтический эффект. Пероральный прием ФЦВ по 250 мг 2 раза в сутки в течение 4 мес. также являлся эффективным при лечении ГГ у женщин с частыми рецидивами. Пролеченные 40 пациенток с часто РГГ отмечали сокращение сроков боли и зуда, отечности и заживления, сокращались сроки обнаружения вируса. Валацикловир (ВАЦ). В силу низкой биоусвояемости АЦ при пероральном приеме (15 %) определенные надежды возлагались на разработку пролекарства, что могло бы улучшить как эффективность, так и удобство применения. Соединение L-валил-ацикловир, или валацикловира гидрохлорид, обладает большей биоусвояемостью при пероральном приеме и до стадии трансформации в АЦ фосфорилированию не подвергается. При пероральном приеме ВАЦ быстро всасывается и почти полностью превращается в АЦ, что, вероятно, происходит благодаря работе недавно описанного фермента кишечника и печени, ВАЦ-гидроксилазы. Механизм действия и ингибиторная in vitro активность АЦ были подробно охарактеризованы ранее. Результаты исследования фармакокинетики АЦ после приема ВАЦ, а также данные по оценке токсичности были сравнимы с таковыми для АЦ. Пероральный прием ВАЦ приводит к повышению биоусвояемости АЦ в 3—5 раз. После приема ВАЦ средний период полужизни АЦ составляет 3,1 ± 0,5 ч для всех тестированных дозировок, что совпадает с показателями для АЦ. Ацикловир представляет собой главный метаболит, обнаруживаемый в моче после приема ВАЦ, причем меньше чем 1 % самого ВАЦ выделяется в неизмененной форме. По итогам многонационального двойного слепого сравнительного изучения эффективности ВАЦ у лиц старше 50 лет с ОГ было показано, что пероральный прием ВАЦ по схеме 1000 мг 3 раза в сутки в течение 7 или 14 дней был эффективен: отмечено сокращение сроков исчезновения болевых симптомов от момента начала исследования. Аналогичным образом ВАЦ усиливал положительный эффект АЦ в отношении заживления кожных высыпаний. Переносимость препарата не отличалась от таковой для АЦ, также между терапевтическими группами не отмечалось различий и в проявлении побочных эффектов. Эти результаты также подтвердили высокую эффективность ВАЦ в терапии ГГ. ВАЦ применяют для лечения инфекций кожи и слизистых оболочек, вызванных ВПГ-1 и ВПГ-2. Препарат назначают при первичном ГГ по 500 мг 2 раза в сутки в течение 10 дней, а при лечении рецидива инфекции — в тех же дозах в течение 5 дней. При ОГ ВАЦ назначают с первых дней высыпаний по 500 мг 3 раза в сутки в течение 2—3 нед., что снижает вероятность развития синдрома ПГН. Для лечения ЦМВ-инфекции у лиц с ослабленным иммунитетом одобрено внутривенное применение ганцикловира и фоскарнета. Проводятся клинические исследования по применению ганцикловира и фоскарнета в терапии инфекции, связанной с ВГЧ-6 у лиц после трансплантации стволовых клеток. На сегодня из противогерпетических препаратов, находящихся на стадии клинического испытания, 5 являются аналогами нуклеотидов либо их пролекарствами; остальные препараты — это фосфорилированные нуклеозиды (нуклеотиды). Для управления ВПГ-инфекцией и ОГ внедрены в практику 4 нуклеотидных аналога: пенцикловир, фамцикловир, валацикловир и лобукавир. Также разрабатывается схема применения ВАЦ для предупреждения ЦМВ-инфекции, а фамцикловира и лобукавира — для лечения вирусного гепатита В. Для подавления ЦМВИ у лиц с ослабленным иммунитетом ведутся исследования по применению пероральных форм ганцикловира, лобукавира, ISIS 2922 и цидофовира. Также проводились исследования по применению соривудина при ОГ. В то же время ведутся работы по применению n-докозанола при ВПГ-инфекциях, а сидофовира — при ВПГ- и ЦМВ-инфекциях, а также для лечения других ВИ. В терапии ЦМВИ сложилось традиционное положение о том, что побочные эффекты от использования специфической терапии труднее контролировать, чем течение самой ЦМВИ, а применение этих препаратов в клинике объясняется лишь тяжестью заболевания и отсутствием более безопасных терапевтических средств. В целом проблема токсичности анти-ЦМВ средств продолжает оставаться одной из главных, хотя положение дел улучшилось в последнее время в связи с разработкой новых лекарственных форм. Сегодня используют таблетки валганцикловира (вальцит) для лечения и профилактики ЦМВИ у лиц со вторичной иммунологической недостаточностью. Препарат обладает низкой токсичностью, высокой клинической эффективностью и хорошей переносимостью. Показал высокую эффективность в доклинических исследованиях новый препарат марибавир (maribavir), который ингибирует синтез киназы UL97 ЦМВ, что способствует прекращению репродукции ЦМВ в клеточной культуре. Механизм действия этого препарата сходен с действием антивирусного препарата ганцикловира. Напротив, анти-ВПГ препараты всегда обладали достаточной безвредностью, служа стандартом безопасности, которой должны удовлетворять все вновь появляющиеся химические соединения. Таким образом, в настоящее время мы окончательно вступили в эпоху противовирусных препаратов второго поколения, предназначенных для лечения герпесвирусных заболеваний. Толчком к усовершенствованию препаратов этой группы послужили известные трудности, связанные с пероральным приемом нуклеозидов, однако итогом работы стало достижение более высоких клинических результатов в отношении ПГН и эпизодического лечения ГГ. Важным является сообщение об ингибиторах хеликаз и праймаз — первых ненуклеозидных антивирусных соединениях, которые, согласно доклиническим данным, значительно превосходят по действию современные средства лечения ВПГ-инфекции. Хеликаза и праймаза — это ферменты TB, которые «разворачивают» вДНК и начинают ее транскрипцию, т. е. участвуют в начальных этапах репродукции вирусов герпеса. Разработанные препараты ингибируют указанные ферменты, прерывая цикл размножения ВПГ. Так, при лечении экспериментального ГГ у морских свинок (ВПГ-2) использовали препарат BAY57-1293 и получили эффект от лечения значительно выше, чем при использовании ВАЦ: быстрее проходили клинические симптомы ГГ, значительно продолжительнее был период ремиссии. Некоторые характеристики другого нового препарата BILS 179 BS: ИД50 (доза препарата, ингибирующая вирусную репродукцию на 50 %) была в 5—50 раз ниже, чем у АЦ и ВАЦ, и в 10—50 раз ниже, чем у ФЦВ. Индекс селективности в 8 раз выше, чем у АЦ и ВАЦ, и в 10 раз выше, чем у ФЦВ. Существенные различия выявлены в частоте резистентности вирусов герпеса к ХП: к АЦ, ВАЦ, ФЦВ — 1*10в-3, а к ингибитору хеликаз-праймаз — от 0,5 до 4*10в-6, т. е. намного реже. Несомненно, препараты ингибиторы хеликаз-праймаз позволят значительно повысить эффективность терапии рецидивирующих ГВИ, улучшат качество жизни пациентов. Несмотря на очевидные успехи в разработке противогерпетических препаратов значительно больше предстоит сделать для определения роли каждого из них в лечении ГВИ. На повестке дня остается разработка нового поколения высокоизбирательных и удобных для применения лекарств против ЦМВ и вновь открываемых видов герпесвирусов. | |
|
| |
| Всего комментариев: 0 | |