11:44 Современные методы диагностики герпесвирусных инфекций | |
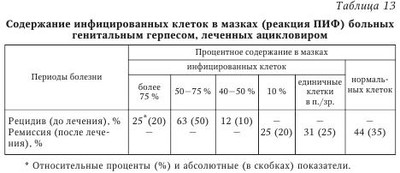
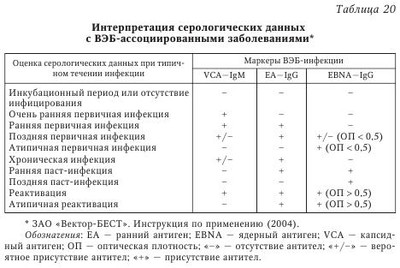
Диагноз ГИ подтверждается с помощью классического вирусовыделения на чувствительных клеточных культурах, иммунофлюоресцентным и серологическим методами, проведением вульвокольпоцервикоскопии, использованием современных молекулярно-биологических методов (ПЦР, лигазной цепной реакции (ЛЦР), дот-гибридизации), что позволяет диагностировать все семейство TB, включая ВГЧ-6, ВГЧ-7 и ВГЧ-8. Показано, что у 76 % больных ГГ вызван ВПГ-2, а у 24 % — ВПГ-1. Причем ГГ как моноинфекция наблюдался лишь у 22—24 % больных. Многие исследователи подчеркивают важную роль одновременного использования нескольких методов диагностики. В качестве скрининговых методов при диагностике ГВИ рекомендуется использовать ПЦР, ИФА и реакцию иммунной флюоресценции (РИФ), а в качестве подтверждающего — метод выделения вируса герпеса на чувствительных клеточных культурах. Предлагаются и другие диагностические алгоритмы. Отношение разных авторов к конкретным методам и диагностическим алгоритмам неоднозначно. Для установления активности инфекционного процесса, наличия рецидивов и хронической стадии болезни возможно использовать следующий алгоритм исследований: 1) принимать во внимание особенности формирования иммунного ответа у пациентов различных групп; 2) учитывать диагностически значимую динамику (нарастание показателей на 2—3 порядка), если это позволяет временной фактор и не требуется оперативной диагностики; 3) использовать комплекс лабораторных тестов в зависимости от цели и задачи исследования, включая (особенно в случае необходимости быстрой диагностики врожденной инфекции) выявление антител класса IgA, низкоавидных IgG (при первичном выявлении) и IgG в спинномозговой жидкости (при поражении ЦНС); 4) исключать сочетанное инфицирование (прежде всего активное течение ЦМВИ и простого герпеса); 5) определять у беременных наличие факторов риска инфицирования плода. Лабораторные методы диагностики ГВИ в настоящее время применяют только в тех случаях, когда необходимо уточнить этиологию или оценить динамику заболевания. Наиболее часто уточнение этиологии заболевания требуется при поражении органа зрения (увеит, конъюнктивит и кератоконъюнктивит), ЦНС (серозный энцефалит и менингит) и половых органов (наружные половые органы, цервицит, уретрит), так как не только ГВ, но и довольно большое число других вирусов вызывают острые и рецидивирующие заболевания этих органов. Важно лабораторно обследовать пациентов на ГВ при наличии неблагополучного акушерского анамнеза, при подозрении на микст-инфекции, пациентов со вторичной иммунологической недостаточностью различного генеза, особенно при наличии лимфаденопатии, длительной лихорадки. В подобных случаях ошибка при выборе этиопатогенетических препаратов и их доз зачастую приводит к серьезным негативным последствиям. Лабораторный контроль за течением герпесвирусных заболеваний необходим при диссеминации процесса, у беременных женщин. В этих случаях малоинформативными окажутся методы определения титров противогерпетических антител, которые часто являются косвенным свидетельством активности процесса и специфического иммунного ответа, в то время как для уточнения этиологии, стадии и течения инфекционного процесса врачи должны располагать сведениями о наличии или отсутствии самих ГВ или их антигенов (табл. 12). Вирусологический метод является «золотым стандартом» в диагностике ГВИ. Отличительной особенностью данного метода является высокая степень достоверности полученных результатов, а также высокая чувствительность (85—100 %) и специфичность (100 %), возможность получения чистой культуры возбудителя для его дальнейшего изучения, в частности, испытания чувствительности к антивирусным препаратам; недостатком — длительность проведения (от 2 до 14 сут). Этот метод недоступен большинству медицинских учреждений, так как культивирование с использованием клеточных культур является процессом трудоемким, дорогостоящим, требующим высокой квалификации персонала. Чувствительность метода зависит от времени, прошедшего с момента забора материала до посева; качества забора материала, условий транспортировки; качества используемых сред и реагентов. Все вышеизложенное обусловило необходимость поиска новых доступных методов диагностики. В исследованиях при вирусологическом обследовании 52 больных в период рецидива простого герпеса ВПГ был выделен на чувствительной культуре клеток Vero в 46 случаях (88,4 %). В зараженных культурах наблюдалась характерная для ВПГ картина цитопатического действия — образование многоядерных гигантских клеток или скопление округлых и увеличенных в размере клеток в виде гроздьев. В 52,1 % случаев уже к 16—24 ч после заражения можно было обнаружить очаги цитопатического действия вируса. К 48—72 ч инкубации зараженных культур процент материалов, вызывающих специфическую деструкцию клеток, увеличился до 87 %. И лишь в 13 % случаев положительные результаты были выявлены через 96 ч после заражения и более или при повторном пассировании. В настоящее время применяется ускоренный вирусологический метод выявления вируса. Сущность метода заключается в том, что материал, полученный от больных, культивируют совместно с культурой клеток Vero в течение 24 ч, после чего клетки культуры фиксируют в холодном ацетоне. Далее проводят выявление антигенов вируса в реакции непрямой иммунофлюоресценции (РНИФ). На фиксированные препараты наносят моноклональные антитела (MKA) к ВПГ. Затем препараты инкубируют во влажной камере в течение 1 ч при температуре 37 °С и промывают проточной водой. После промывки на препараты наслаивают антивидовой конъюгат — меченные ФИТЦ (флюоресцеинизотиоцианатом) антитела против иммуноглобулинов мыши — и помещают в камеру на 30 мин при температуре 37 °С. Окрашенные препараты исследуют с помощью люминесцентного микроскопа. При микроскопии определяют вирусспецифические включения в виде образований с зеленой или желто-зеленой флюоресценцией в ядре и/или цитоплазме эпителиальных клеток. Включения могут иметь зернистую, гомогенную или смешанную структуру. Ценность данного метода состоит в том, что он позволяет выбрать антивирусный препарат для лечения ГИ и оценить эффективность противовирусной терапии через 1,5—2 мес. после окончания лечения. Результаты лабораторного обследования устанавливаются в течение двух суток. Самыми первыми методами диагностики ГВИ являлись методы прямой цитологигеской индикации ГВ в клетках. При наличии вируса в пораженных тканях цитологический метод позволяет обнаружить гигантские округлые многоядерные клетки со специфическими внутриядерными включениями, при ЦМВ — гигантские, округлые клетки с ядром, занимающим почти всю цитоплазму, увеличенным за счет гомогенного включения («совиный глаз»). Показаниями для проведения цитологического метода исследования ГИ являются бессимптомное течение, а также острая фаза заболевания. Простота метода привлекает к нему исследователей до настоящего времени, однако большинство авторов признают его несовершенным и ненадежным. Недостатком метода является невозможность дифференцирования первичной инфекции от рецидивирующей, а также уточнения типа ВПГ, являющегося причиной заболевания. Кроме того, чувствительность и специфичность метода не превышают 75 % по сравнению с методом выделения вируса в культурах тканей и зависят от получения достаточного количества клеток для исследования, т. е. правильного забора материала. Широко используемые в настоящее время иммуноморфологигеские методы основаны на обнаружении антигенных субстанций в тканях путем обработки препаратов специфическими антителами, меченными флюоресцентом либо ферментом. Теоретически иммунофлюоресцирующие и иммуноферментные методы, как и все реакции антиген—антитело, должны быть высоко специфичны. Однако на практике достоверность результата зависит в значительной мере от качества специальных реагентов — специфических антител-конъюгированных иммуноглобулинов, выпускаемых разными фирмами. Иммунофлюоресцентный метод основан на обнаружении светящихся комплексов антигена возбудителя (липополисахарида или основного белка наружной мембраны) со специфическими антителами с использованием люминесцентного микроскопа. При люминесцентной микроскопии вирусы герпеса имеют специфическое интенсивное изумрудно-зеленое свечение. Антиген вируса может быть обнаружен только в ядре, в ядре и цитоплазме неизмененных клеток. Многие авторы считают положительным результат внутриклеточной флюоресценции при наличии не менее трех светящихся антигенсодержащих клеток. Достоинствами РИФ являются невысокая стоимость, высокая специфичность (90 %) и чувствительность (55—75 %), быстрота получения результатов (в пределах 2 ч), а недостатками — зависимость результатов от качества забора материала, стадии заболевания и квалификации врача-вирусолога. Часто в практической работе используется метод прямой иммунофлюоресценции (ПИФ) с поликлональными или моноклональными антителами против ВПГ-1 и ВПГ-2. Метод ПИФ достаточно легко воспроизводим в обычной клинической лаборатории, не является дорогостоящим, чувствительность его выше 80 %, специфичность 90—95 %. При иммунофлюоресцентной микроскопии выявляли наличие цитоплазматических включений, морфологические особенности, процент инфицированных клеток в мазках-соскобах из уретры, цервикального канала, шейки матки, прямой кишки. Метод ПИФ дает представление о морфологических свойствах клеток и изменении локализации антигенов ВПГ. Кроме прямых признаков поражения клеток вирусами герпеса (обнаружение специфического свечения), имеются косвенные признаки герпетической инфекции по данным ПИФ: а) агрегация ядерного вещества, отслаивание кариолеммы; б) наличие так называемых «ядер-дырок», когда от ядра клетки остается только одна кариолемма; в) наличие внутриядерных включений — телец Каудри. При постановке ПИФ врач получает не только качественную, но и количественную оценку состояния инфицированных клеток, что используется для оценки эффективности проводимой противовирусной терапии АЦ. Так, 80 больных простым ГГ обследованы методом ПИФ в динамике. Показано, что если до лечения АЦ в мазках 88 % больных был высокий процент инфицированных клеток (50—75 % и выше), то после одного курса АЦ в мазках 44 % больных выявлялись здоровые клетки, в 31 % случаев отмечены единичные инфицированные клетки и у 25 % больных было до 10 % инфицированных клеток (табл. 13). Используя многие годы ПИФ и метод дот-гибридизации, мы отметили почти в 100 % случаев совпадение результатов исследования. С помощью дот-гибридизации и ПЦР мы уточняли (типировали) ВПГ-1 и ВПГ-2 инфекции, оценивали эффективность лечения. Следует отметить, что для повышения надежности диагностики ГГ, особенно в случаях наличия субклинических и маломанифестных форм герпеса, рекомендуется использовать в работе 2—3 метода лабораторной диагностики, особенно при обследовании беременных, женщин с неблагополучным акушерским анамнезом, лиц с неуточненным гинекологическим диагнозом. Другим методом, позволяющим выявить антигены вируса герпеса, является иммуноферментный анализ (ИФА). Данный метод определяет антигены с помощью антител, меченных ферментом. Преимуществом ИФА по сравнению с РИФ являются: большая степень чувствительности, стандартизация и автоматизация исследований, снижение частоты субъективных ошибок, связанных с квалификацией врача-лаборанта. Чувствительность метода составляет 70—80 %. Важную роль для диагностики стадии ГИ имеет определение противовирусных антител. Метод ИФА позволяет определить вирусные антитела классов IgG, IgA, IgM в сыворотке крови. Простота, высокая специфичность и чувствительность, а также невысокая стоимость этого метода и возможность определения стадии заболевания сделали его наиболее распространенным в диагностике ГИ. Недостатком метода является возможность получения ложноположительных результатов за счет перекрестных реакций с нормальными антителами. Степень выраженности клинических проявлений инфекции может зависеть от количества возбудителя. К примеру, лечение СПИДа в настоящее время проводится в зависимости от уровня так называемой вирусной нагрузки. Возможность оценить этот уровень дает количественная ПЦР. Ho из-за высокой стоимости данного метода он пока не может широко использоваться. Иммуноферментный анализ остается и в этом случае незаменимым методом. Информативность зависит от формы инфекции (первичная, рецидивирующая), состояния иммунореактивности организма больного, длительности заболевания, проведенной терапии и т. д. После внедрения вируса герпеса в организм человека начинается синтез специфических иммуноглобулинов класса M (IgM), которые определяются на 4—6-й день после инфицирования и достигают максимального значения к 15—20 сут. С 10—14 сут. начинается продукция специфических IgG, несколько позднее — IgA. В организме человека IgM и IgA сохраняются недолго (1—3 мес.), IgG — в течение всей жизни. Диагностическое значение при первичной ГИ имеет выявление IgM и/или четырехкратное увеличение титров специфических иммуноглобулинов G (IgG) в парных сыворотках крови, полученных с интервалом в 14—21 день. Рецидивирующий герпес обычно протекает на фоне высоких показателей IgG, свидетельствующих о постоянной антигенной стимуляции организма больного. Нередко диагностика активной фазы инфекции по четырехкратному приросту титра IgG вызывает затруднения, поскольку титр IgG антител может увеличиваться достаточно быстро (в течение 1—2 сут.) после проявления симптомов заболевания. В случае обнаружения IgG антител любого уровня рекомендуется тестировать сыворотки на IgM антитела, особенно к ЦМВ. При герпесе формируется так называемый нестерильный иммунитет, который отражает инфицированность организма, а не защищенность от инфекции. В то же время показана связь между уровнем вируснейтрализующих антител в крови к ГВ и вирусемией, доказательством которой служит выделение из крови больных ГВ в системе культуры ткани. Инфекции, вызываемые ВПГ, ЦМВ и ВЭБ, относятся к инфекциям с нетипигной динамикой антителообразования (когда наличие IgM не является достоверным и достаточным признаком для дифференциации стадий заболевания). В то же время появление IgM является признаком первичного инфицирования или обострения латентно протекающей инфекции. Иногда антитела к ГВ класса M могут циркулировать в крови более 3 мес. (до нескольких лет). Этот феномен связывают с нарушением иммунитета у лиц с ГИ. С другой стороны, у иммуноскомпрометированных пациентов при рецидивах ГИ антитела к вирусу (как IgM, так IgG) могут не выявляться. Ложноотрицательный ответ на анти-ВПГ IgM может быть у новорожденных. При отсутствии IgM антител критерием тяжести заболевания могут служить уровни IgG антител, особенно при герпесе. Схематически интерпретация результатов исследования сывороток на антитела к ВПГ-1, ВПГ-2 может быть представлена следующим образом: низкий и средний уровень IgG антител — ремиссия, высокий уровень — обострение (см. табл. 18). Если в сыворотках обнаружены высокие уровни IgG-антител к ГВ, то рекомендуется дополнительно тестировать их методом ПЦР, который достоверно указывает на присутствие вируса в организме. Все вышеперечисленное свидетельствует о сложности клинической трактовки полученных результатов. Тем не менее серологическое обследование необходимо проводить, и делать это надо методом «парных» сывороток (с интервалом 2—3 нед.), несмотря на то что чаще серологическая диагностика ГИ имеет второстепенное значение. Отмечено, что 20 % больных ВПГ-2 не имеют симптомов болезни вообще, а у 60 % лиц есть признаки, которые не принимаются врачом и самими больными за герпес (нетипичные проявления). Обе эти группы рискуют заразить своих партнеров. Специфические IgM не могут быть использованы в качестве достоверного маркера для диагностики острой и, особенно, первичной инфекции, так как IgM к ВПГ могут формироваться как при первичном инфицировании, так и при реинфекции и реактивации вируса, но в то же время они способны вырабатываться в достаточном для диагностики количестве только у 30 % больных. Специфические IgA также могут присутствовать в сыворотке периферической крови через 2—3,5 года с момента зарегистрированной сероконверсии. При определении IgM антител можно получить ложноотрицательные результаты, поскольку данные антитела могут вообще не образовываться или присутствовать в количествах, недостаточных для диагностики. Ложноотрицателъные результаты могут быть вызваны следующими причинами: 1) длительная персистенция IgM антител или их присутствие могут быть не связаны с инфекцией; 2) IgM антитела могут определяться при реактивации инфекции или при вторичной инфекции, например ВИЧ; 3) различные вирусы могут иметь общие эпитопы (например, ВПГ и ВВО), что приводит к возникновению перекрестных реакций. Таким образом, для подтверждения ГИ в диагностически сложных случаях необходимо комплексное вирусологическое обследование больных, включающее выделение вируса в культуре тканей, обнаружение вирусспецифического антигена и анализ серологических показателей в динамике. В то же время постановка диагноза ГИ только на основании серологического исследования может повлечь за собой диагностическую ошибку. Определение серологических маркеров при ГВИ не может служить специфическим тестом для дифференциации первичной инфекции и реактивации. Единственным способом, позволяющим сразу и достоверно диагностировать первичную инфекцию, является определение индекса авидности специфических антител. Для того чтобы установить точный момент инфицирования и разграничить первичную инфекцию, реинфекцию и реактивацию инфекционного процесса, в 1988 г. был предложен тест на определение авидности IgG антител. Следует различать два понятия: аффинность (или аффинитет) и авидность (или авидитет) антител. Аффинность — это степень специфического сродства активного центра к антигенной детерминанте; авидность (или функциональная аффинность) — это прочность связи между антителом и антигеном. Величина авидности зависит от аффинности специфических антител (чем выше аффинность, тем выше авидность) и количества связывающих центров (Методические рекомендации, 2004). Известно, что первичный иммунный ответ на первую встречу с антигеном начинается с продукции иммуноглобулинов класса M (IgM). Специфические IgG появляются позже, они сменяют ранние антитела IgM и накапливаются в организме в больших количествах. Под воздействием антигена происходит процесс отбора и стимуляции В-клеток, что приводит к увеличению аффинности IgG антител, низкой после первого контакта с антигеном и возрастающей в течение последующих недель или месяцев. В связи с соматическими мутациями в генах, кодирующих вариабельные участки IgG, возрастает прочность связывания в комплементарных участках антигенов и антител. Через месяц после инфицирования вариабельные участки антител становятся более специфичными по отношению к антигену, и аффинность IgG антител возрастает. Этот процесс называется созреванием антител. Высокоаффинные антитела долго присутствуют в организме, обеспечивая развитие быстрого вторичного иммунного ответа при повторном контакте с возбудителем. Уровень авидности пропорционален дозе и природе антигена, а также индивидуальному уровню соматических мутаций. Низкие дозы антигена способствуют более быстрому возрастанию авидности, а высокие дозы — более медленному. Следовательно, низкоавидные антитела синтезируются в течение первой стадии инфекции, когда содержание антигенов обычно высокое. С возрастом эффективность селекции специфических антител падает и процесс созревания антител замедляется, в связи с чем у людей старше 60—65 лет понижается устойчивость к инфекциям и снижается эффект от вакцинации. Авидность специфических IgG при серодиагностике возбудителей инфекционных заболеваний определяют различными методами: агглютинацией, радиоиммунным методом, РСК, ИФА, электроблоттингом и электрофорезом. Чаще определяют показатель индекса авидности при помощи ИФА. Суть метода заключается в следующем. В процессе инкубации образцов сыворотки крови с адсорбированными на планшете антигенами образуются иммунные комплексы. После промывания планшета в часть лунок добавляют раствор, который способствует удалению «ранних» IgG с низкой авидностью (денатурирующий агент). После внесения конъюгата контролируют его связывание с комплексом антиген—антитело с помощью раствора хромогена. После остановки ферментативной реакции измеряют спектрофотометром оптическое поглощение окрашенного раствора. Наличие в исследуемом образце вирусспецифических IgG антител с низкой авидностью определяется по снижению интенсивности окрашивания в сравнении с лунками, обработанными раствором сравнения (Методические рекомендации, 2004). В качестве денатурирующего вещества используют диэтиламид, тиоционат калия, глютаральдегид, мочевину. Показано, что обработка 8М раствором мочевины является самым простым методом измерения авидности IgG, однако этот метод менее чувствителен, чем метод с применением диэтиламина, так как он не позволяет определять низкоавидные антитела спустя 3 мес. после первичного инфицирования. Индекс авидности (ИА) антител сывороток рассчитывают по формуле; ИА = OП1 х 100/ОП2, где OП1 — оптическая плотность в лунках с антигенами после обработки денатурирующим агентом; ОП2 — оптическая плотность в лунках с той же сывороткой после обработки раствором сравнения. Выявление в испытуемой сыворотке антител с ИА ниже 30—50 % (у разных производителей) указывает на свежую первичную инфекцию. Показатель ИА, равный или превышающий 50 %, свидетельствует о присутствии в сыворотке высокоавидных антител — маркеров перенесенной в прошлом инфекции. Показатель авидности антител в пределах 31—49 % может говорить о поздней стадии первичной инфекции или недавно перенесенной инфекции (ранняя паст-инфекция) только при условии выявления высоких концентраций антител. Интерпретировать результаты определения ИА необходимо в строгом соответствии с рекомендациями фирмы-производителя, так как величина ИА для одной и той же стадии заболевания может колебаться в широких пределах, в зависимости от способа разрушения иммунного комплекса и природы используемого денатуранта. Таким образом, если в исследуемой сыворотке крови при наличии или отсутствии IgM обнаруживаются IgG с низкой авидностью, это свидетельствует о первичной (недавней) инфекции. Присутствие высокоавидных антител IgG указывает на вторичный иммунный ответ в случае попадания возбудителя в организм или обострения (реактивации) заболевания. Тест на авидность прост в исполнении, доступен для большинства иммунологических лабораторий. В табл. 14—20 представлены основные методы лабораторной диагностики ГВИ, а также рекомендованы биологические материалы, которые исследуются при выделении ВПГ с учетом локализации герпетических поражений (см. табл. 15). В табл. 14 дан перечень основных и вспомогательных методов лабораторной диагностики генерализованных форм герпеса. Для диагностики инфекционного мононуклеоза (инфекции, вызванной ВЭБ) используют вирусологические, молекулярно-биологические и серологические методы, реакцию Пауля Буннеля с эритроцитами барана (диагностический титр 1 : 28 и выше) при однократном исследовании сыворотки крови либо четырехкратный прирост антител при обследовании парных сывороток. Используют реакцию Гоффа — Бауэра со взвесью 4 % формалинизированных эритроцитов лошади. Результат учитывают через 2 мин, при инфекционном мононуклеозе реакция высокоспецифична. В настоящее время разработан метод ИФА диагностики инфекционного мононуклеоза. При этом антитела классов IgG и IgM в сыворотке больного определяют путем ее инкубации с лимфобластами, зараженными ВЭБ, с последующей обработкой флюоресцирующими антителами. В остром периоде заболевания антитела к вирусному капсидному антигену определяются в титре 1 : 160 и выше. Серологическая диагностика ВЭБ-инфекции представляет определенные трудности, она основана на выявлении специфических антител к нескольким антигенам вируса, однако не существует единого надежного теста, позволяющего получать достоверную информацию для постановки окончательного диагноза. На ранних стадиях развития инфекции в образцах сыворотки крови пациента обнаруживаются IgM и IgG к нуклеарному антигену (IgM-VCA и IgG-VCA). Активная фаза инфекционного мононуклеоза также характеризуется продукцией низкоавидных антител IgG к VCA и в большинстве случаев наличием IgG, специфичных к комплексу ранних антигенов. IgM антитела к нуклеарному антигену (EBNA) могут служить индикатором острой инфекции, однако ряд авторов отмечает частое возникновение ложноположительных реакций вследствие неспецифической реактивности. Показано, что антитела к ядерному белку EBNA-1 р72 являются маркерами только паст-инфекции. Появление IgM анти-VCA антител может происходить с опозданием или вообще не происходить. С другой стороны, IgM анти-VCA могут выявляться в течение нескольких месяцев после первичного инфицирования, повторно появляться при реактивации инфекции, а также при мононуклеозах иной этиологии (ЦМВ, токсоплазмоз, гепатит А, ВИЧ). Эффективность определения авидности IgG к VCA антигену ВЭБ была показана в работах ряда авторов. Возможны варианты интерпретации результатов серологического обследования больных с ВЭБ-инфекцией с учетом качественных характеристик тест-систем других фирм-изготовителей (см. табл. 20). При использовании ряда импортных коммерческих тест-систем в ИФА можно выявить: антитела к антигенам оболочки ВЭБ; антитела к раннему антигену ВЭБ; общие антитела к раннему антигену ВЭБ, определяющиеся в острой фазе заболевания в ядре и в цитоплазме клетки, ограниченные антитела к раннему ВЭБ, определяющиеся в острой фазе заболевания в ядре и в цитоплазме клетки; ограниченные антитела к раннему антигену ВЭБ, определяющиеся в разгар заболевания только в цитоплазме клетки, и антитела к ядерному антигену ВЭБ. Использование данных тест-систем позволяет проводить дифференциальную диагностику ряда заболеваний, связанных с ВЭБ. После положительного результата ИФА, выявившего антитела к ВЭБ, ставят подтверждающую реакцию иммуноблотинга, в которой определяют наличие антител к отдельным маркерным белкам ВЭБ (р — протеины): р23, р54, р72 (наличие этого белка указывает на возможность размножения ВЭБ), р138 и др. Указанные выше лабораторные методы используют и для контроля эффективности лечения. Приведем пример диагностики инфекции, связанной с ВЭБ. В настоящее время широко используются молекулярно-биологигеские методы, основанные на амплификации ДНК (метод ПЦР). В то время как ПИФ, ИФА и другие методы ориентированы на выявление микроорганизма на основании его фенотипических признаков (продуцирования антигенов), проявление которых зависит от экспрессии генов, молекулярно-биологические технологии позволяют определить непосредственно генотипическую принадлежность бактерии или вируса. Основные достоинства молекулярно-биологических методов — высокая чувствительность (90—98 %) и специфичность (90—100 %). По мнению некоторых исследователей, метод ПЦР сходен по чувствительности с ИФА и более чувствителен, чем заражение клеточной культуры. Надо отметить, что на качество диагностики влияет не только метод, но и правильность забора материала. Она важна и имеет свои особенности при иммуноморфологических и молекулярно-биологических методах исследования. Однако не все авторы считают методы, основанные на выявлении ДНК-возбудителя, идеальными. Остаются неучтенными ошибки, связанные с возможным присутствием в пробе от больного ингибиторов ДНК-полимеразы или с нарушением условий забора и хранения материала и др. Так, при ПЦР-диагностике вирусно-бактериальных инфекций урогенитального тракта необходимо проводить оценку полученных положительных результатов с учетом анамнеза, наличия (или отсутствия) конкретных клинических симптомов болезни. Если с помощью ПЦР выявлены хламидии, то с большой вероятностью можно говорить об инфицировании и решать соответствующим образом вопросы терапии. В случае обнаружения микоплазм (уреаплазм), являющихся условно-патогенными микроорганизмами, для подтверждения диагноза требуется провести дополнительно культуральные исследования, т. е. посев материала от больного на чувствительные клеточные культуры. Только при получении положительных результатов при культуральном анализе можно говорить о лабораторном подтверждении диагноза микоплазмоза. Этот же метод позволит при необходимости определить и чувствительность выделенных микоплазм к часто используемым лекарственным формам (антибиотикам, фторхинолонам и пр.). Возможно одномоментное инфицирование несколькими вирусами семейства Herpesviridae. Нередко мы выявляли инфицирование одного пациента вирусами ВПГ-1, ВПГ-2 и ЦМВ. Значительно чаще инфицированы несколькими вирусами герпеса были пациенты с клинико-лабораторными проявлениями вторичных ИДС (больные онкогематологические, онкологические, ВИЧ-инфицированные). Так, показано, что прогрессирующие при ВИЧ-инфекции клинико-иммунологические нарушения сопровождаются увеличением числа выявляемых методом молекулярной гибридизации герпесвирусов. При этом прогностически наиболее значимым можно считать комплексное одномоментное выявление ДНК ВПГ-1, ЦМВ и ВГЧ-6 типов. Выделение ДНК из биологического материала проводят согласно инструкциям к наборам выделения, которые рекомендуются производителями диагностических тест-систем для ПЦР, предназначенных для выявления вирусной ДНК. В настоящее время производители диагностических тест-систем для ПЦР анализа производят и наборы выделения ДНК/РНК. До некоторого времени учет результатов ПЦР осуществляли только с помощью гель-электрофореза, что затрудняло полноценную интеграцию метода ПЦР в инфраструктуру диагностической лаборатории из-за риска контаминации продуктами амплификации. Однако ситуация принципиально изменилась с появлением модификации метода ПЦР, позволяющей совместить амплификацию с одновременной детекцией накопления ее продуктов непосредственно в процессе реакции, не прибегая к их извлечению из пробирок. Такая модификация ПЦР за рубежом получила название Real-Time PCR, или ПЦР в реальном времени (ПЦР-РВ). Отличительными чертами данного метода, в отличие от классической ПЦР, является возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале, отсутствие стадии электрофореза, менее строгие требования к организации ПЦР-лаборатории и автоматическая регистрация и интерпретация полученных результатов. Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и таким образом резко уменьшить число ложноположительных результатов. Поскольку регистрация результатов проводится непосредственно в процессе ПЦР, весь анализ можно проводить в одной-двух комнатах лаборатории и нет необходимости в отдельном помещении для детекции продуктов реакции. В нашей стране уже разработаны тест-системы на основе ПЦР-РВ и налажено их серийное производство. Тест-системы производства ФГУН ЦНИИ эпидемиологии Роспотребнадзора с торговой маркой «Амплисенс» для выявления возбудителей ИППП прошли государственную регистрацию и получили регистрационные удостоверения Росздравнадзора. Тест-системы для выявления ДНК герпесвирусов выпускают различные производители. Метод иммуноблота (Westernblot, Line-blot) — новое поколение подтверждающих тестов на инфекции. Представляет собой индивидуальный оценочный шаблон и имеет возможность автоматизации исследования. При ВИЧ-инфекции является основным диагностическим тестом. Позволяет определять антитела к отдельным антигенам возбудителя. (Line-blot отличается от Westernblot тем, что на мембрану нанесены только диагностически значимые белки.) Иммуноблот в настоящее время хорошо зарекомендовал себя в диагностике ряда заболеваний: ВИЧ-инфекции, вирусного гепатита С, боррелиоза, сифилиса, ЦМВИ, инфекционного мононуклеоза (ВЭБ-инфекции), простого герпеса, хеликобактериоза и пр. Он позволяет раздельно детектировать IgM и IgG к отдельным белкам, что значительно повышает эффективность как диагностического процесса (в том числе при диагностике врожденных и перинатальных инфекций), так и мониторинга. Поставка таких наборов фирмы «Euroimmun» (Германия) осуществляется российскими фирмами ЗАО «Аналитика» и ООО «Лабораторная компания ДИАКИТ» (Москва). Например, при диагностике ВЭБ-инфекции с помощью иммуноблота выявление белка VCA 125 указывает на раннюю фазу инфекции. В разгаре болезни и на этапе завершения острого процесса появляются VCA 19. О поздней фазе свидетельствует высокоспецифичный маркер VCA 22, который выявляется самостоятельно или совместно с EBNA-1 (р79). Последний белок длительно присутствует у переболевших и свидетельствует о перенесенной инфекции. Для адекватной терапии ГВИ недостаточно только выявить возбудителя заболевания. Необходимо иметь представление о характере течения инфекционного процесса. Таким образом, диагноз ГВИ должен устанавливаться по совокупности анамнестических, эпидемиологических, клинических данных и доступных лабораторных методов исследования: цитоморфологического исследования мазков для обнаружения многоядерных гигантских клеток и внутриклеточных включений; выделения вируса на хорионаллантоисной оболочке куриных эмбрионов или в культуре клеток; иммуноферментного анализа для определения титра специфических противовирусных антител (и антигенов вирусов); определения вирусной ДНК с помощью ПЦР. | |
|
| |
| Всего комментариев: 0 | |