12:02 Тест-системы ЗАО «ЭКОлаб» для диагностики простого герпеса и цитомегаловирусной инфекции | |
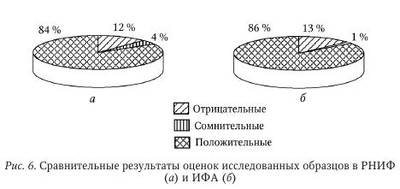
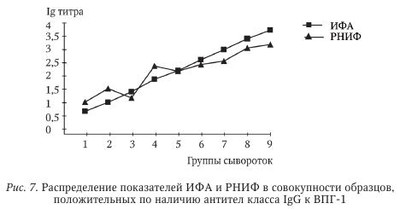
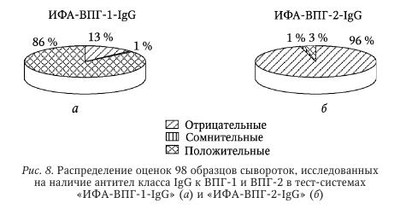
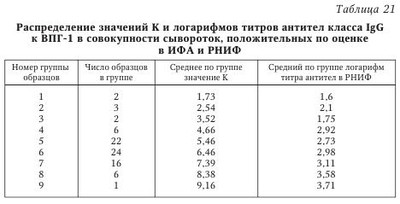
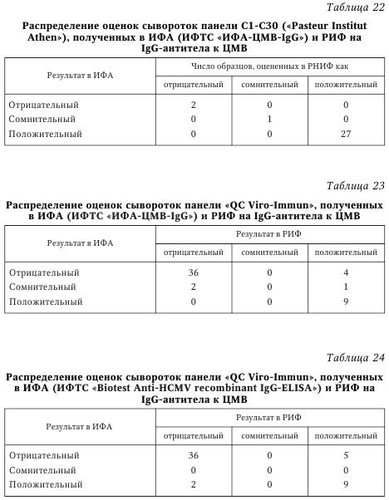
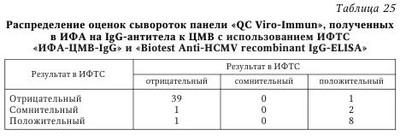
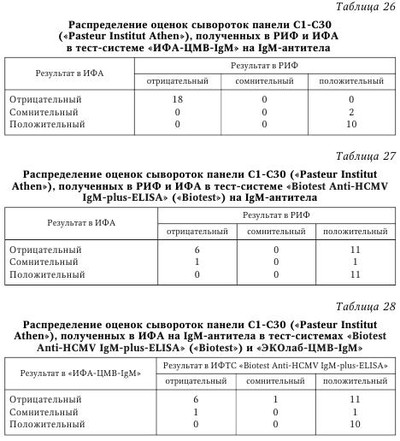
Простой герпес. Тест-системы «ИФА-ВПГ-1-IgG», «ИФА-ВПГ-2-IgG», «ИФА-ВПГ-1+2-IgM» и «ИФА-ВПГ-1+2-IgG» разработаны ЗАО «ЭКОлаб» совместно с фирмой «Viro-Immun Diagnostics» (Германия). В основу этих тест-систем положен метод непрямого ИФА, когда на поверхности лунок полистирольного планшета сорбируется специфический антиген, а наличие специфических антител в исследуемом образце после их связывания с антигеном определяется с помощью антительного конъюгата по реакции хромогена, добавляемого в лунки на заключительной стадии постановки. Очевидно, что одним из важнейших элементов в разработке таких тест-систем является получение иммуносорбента, т. е. сорбция специфического антигена на поверхности лунок полистиролового планшета. Здесь крайне важны характеристики сорбируемого антигена, качество используемого планшета и сама технология сорбции. Для приготовления иммуносорбентов в указанных тест-системах были использованы высокоочищенные натуральные антигены ВПГ-1 и ВПГ-2 штаммов MS и G (ATCC), полученные фирмой «Viro-Immun» из разрушенных ультразвуком культур клеток почки обезьяны. Для сорбции антигенов были использованы разборные планшеты «Maxi-sorb» фирмы «Nunk» (Дания), несомненным достоинством которых, помимо характеристик, обычных для высококачественных планшетов для ИФА, является возможность использования в постановке любого числа лунок стрипа, так как врач может отламывать необходимое для работы число лунок. Сама технология приготовления иммуносорбента включает шесть этапов — сорбция антигена, отмывка, лиофильная сушка в атмосфере азота, инкубация с блокирующим раствором, повторная лиофильная сушка в атмосфере азота и запайка планшетов в вакуумных пакетах. Как показали последующие испытания тест-систем, именно такая многоэтапная технология получения иммуносорбента гарантирует его качество и стабильность в течение не менее I года. Важным моментом конструирования тест-систем является выбор системы контрольных образцов. В указанных тест-системах использованы три контрольных образца — K+, K- и Kпор. Они выполняют не только функции контроля правильности постановки ИФА, для чего хватило бы K+ и Ka Третий контрольный образец, Kпор т. е. образец с содержанием антител, который можно считать «порогом», разделяющим исследуемые образцы на «положительные» (содержащие антитела в диагностическом титре) и «отрицательные» (не содержащие антитела или содержащие антитела в титре, ниже диагностического), позволяет обходиться без расчетов так называемых «пороговых» значений оптической плотности (ОПпор) при учете результатов анализа и непосредственно использовать как ОПпор значение ОП в лунках с этим контрольным образцом. Кроме того, в наборах «ИФА-ВПГ-1-IgG» и «ИФА-ВПГ-2-IgG» K+ и Kпор используются для определения титра антител, без дополнительных постановок ИФА с титрованием исследуемых образцов. Это стало возможным за счет включения в наборы K+ и Kпор с предварительно определенными титрами антител. Получив значения ОП в лунках с этими образцами и зная титры антител в них, можно построить калибровочный график, определяя уже по нему титры антител в исследуемых образцах. Так что K+ и Kпор выполняют в указанных тест-системах еще и функции калибраторов. В качестве конъюгата во всех тест-системах использованы антитела диагностические мышиные против иммуноглобулинов человека классов IgG и IgM, соответственно, меченные пероксидазой. Помимо этих специфических компонентов, тест-системы для определения антител класса IgG включают: раствор индикаторный (стабилизированный раствор хромогена — тетраметилбензидина) и обычные для большинства иммуноферментных тест-систем (ИФТС) вспомогательные растворы — концентрат отмывающего раствора, содержащий детергент, буферный раствор для разведения сывороток и стоп-реагент (кислота серная, 1 моль/л раствор). В набор тест-системы для выявления антител класса IgM, кроме того, входит блокирующий раствор, вводимый в исследуемые образцы для устранения интерференции (которая может сказаться на результатах ИФА) IgG-антител, ревматоидного фактора и антинуклеазных антител. Все компоненты тест-систем, кроме концентрата отмывающего раствора, готовы к работе и отличаются друг от друга окраской или цветом упаковки. Все тест-системы имеют унифицированный протокол постановки ИФА. Анализ со всеми тест-системами может быть проведен с использованием автоматических анализаторов. Время анализа составляет 1 ч 15 мин при выявлении IgG-антител и 1 ч 45 мин при выявлении IgM-антител. (Кроме указанных в схеме этапов, исследуемые образцы перед внесением в лунки иммуносорбента в течение 30 мин обрабатываются блокирующим раствором.) ИФА со всеми тест-системами ставится при комнатной температуре, т. е. для работы не требуется термостат и, соответственно, не возникает так называемый «краевой эффект», нередко имеющий место при инкубации в термостатах больших количеств планшетов и отрицательно сказывающийся на точности анализа. Использование именно натуральных антигенов ВПГ и включение в тест-систему для выявления IgM-антител специального блокирующего раствора значительно повышает специфичность анализа, доказательством чего могут быть результаты сравнительных испытаний тест-систем «ИФА-ВПГ-1+2-IgM» и аналогичной системы фирмы «Вектор Бест», в которой для приготовления иммуносорбента использованы рекомбинантные аналоги антигенов ВПГ. При исследовании 34 сывороток, не содержавших по данным предварительного исследования IgM-антител к ВПГ, тест-система «ИФА-ВПГ-1+2-IgM» во всех случаях дала отрицательный результат, тогда как тест-система сравнения оценила 2 образца как положительные и 2 образца как сомнительные. Итак, фактором, существенно повышающим диагностическую ценность ИФА при диагностике ГИ, является возможность дифференциации типоспецифичности возбудителя. Для оценки способности тест-систем «ИФА-ВПГ-1-IgG» и «ИФА-ВПГ-2-IgG» дифференцированно определять антитела класса IgG к ВПГ обоих типов было проведено сравнительное исследование 98 образцов сывороток, предварительно исследованных на наличие соответствующих антител в реакции непрямой иммунофлюоресценции (РНИФ). При этом 14 образцов были оценены как отрицательные, 2 образца были оценены как сомнительные и 82 — как положительные. По результатам ИФА те же образцы оценивались с использованием соотношений оптических плотностей, полученных в лунках с исследуемыми образцами, и оптической плотности в лунках с Kпор, т. е. по величинам К = ОПиссл : ОПКпор. Соответственно, значение К, меньшее 1,0, позволяло оценивать результат ИФА как отрицательный, значение К, большее 1,0, — как положительный, а значение К, равное 1,0, — как сомнительный, или «пороговый». Соотношение оценок образцов в ИФА и РНИФ, полученное при определении антител класса IgG, представлено диаграммами на рис. 6. Данные, представленные на рисунке 6, свидетельствуют о высокой степени соответствия оценок образцов, полученных обоими методами. Об этом же свидетельствует сопоставление значений коэффициента К и титров антител, полученных в РНИФ, при исследовании сывороток, оцененных обоими методами как положительные (табл. 21 и рис. 7). Приведенные данные не оставляют сомнений в наличии тесной связи между обоими показателями, что доказывает надежность определения титра антител класса IgG к ВПГ-1 с использованием тест-системы «ИФА-ВПГ-1-IgG». Te же 98 образцов сыворотки были исследованы затем в тест-системе «ИФА-ВПГ-2-IgG». Распределение полученных при этом оценок в сравнении с оценками, полученными в тест-системе «ИФА-ВПГ-1-IgG», представлено в диаграммах на рис. 8. Как видно из рисунка 8, налицо четкая дифференциация типоспецифичности антител в исследованных образцах. Причем те 4 % (4 случая), в которых этой дифференциации не произошло, скорее всего, связаны с тем, что соответствующие сыворотки действительно содержат антитела к обоим типам вируса, поскольку для этих образцов характерны высокие значения коэффициента К в обоих тест-системах и высокие титры в РНИФ. Столь же убедительные результаты были получены при исследовании в указанных тест-системах сывороток стандартной панели в ГИСК им. Л. А. Тарасевича. Все 16 отрицательных сывороток указанной панели в обеих тест-системах также были оценены как отрицательные; все 17 сывороток, содержавших IgG-антитела к ВПГ-1, были оценены как положительные в тест-системе «ИФА-ВПГ-1-IgG» и как отрицательные в тест-системе «ИФА-ВПГ-2-IgG», а 3 сыворотки, содержавшие IgG-антитела к обоим типам вируса, были оценены как положительные обеими тест-системами. Тест-системы «ИФА-ВПГ-1-IgG», «ИФА-ВПГ-2-IgG», «ИФА-ВПГ-1+2-IgM» и «ИФА-ВПГ-1+2-IgG» успешно проходят практическую апробацию в различных медицинских учреждениях. Так, положительные отзывы о них получены уже из Санкт-Петербургского ГУЗ «Городской диагностический центр (вирусологический)», из Вологодского МУЗ «Диагностический центр» и других организаций. Цитомегаловирусная инфекция. Тест-системы «ИФА-ЦМВ-IgM» и «ИФА-ЦМВ-IgG», разработанные ЗАО «ЭКОлаб» совместно с фирмой «Viro-Immun Labour Diagnostics» (Германия), основаны на непрямом методе ИФА на твердой фазе. При наличии в исследуемом образце специфических антител к ЦМВ они связываются с антигенами ЦМВ, сорбированными в лунках планшета, и образовавшийся комплекс антиген иммуносорбента — специфическое антитело образца выявляется после добавления конъюгата (антител к IgM или IgG человека, меченных пероксидазой) по цветной реакции с раствором тетраметилбензидина (ТМБ), интенсивность которой зависит от содержания антител к ЦМВ в образце. Схемы постановки ИФА с обеими тест-системами также одинаковы. Общеизвестно, что важнейшими элементами в разработке тест-систем для ИФА являются получение иммуносорбента, конъюгата и контрольных образцов. При разработке ИФТС «ИФА-ЦМВ-IgM» и «ИФА-ЦМВ-IgG» для приготовления иммуносорбента были использованы высокоочищенные антигены возбудителя, выделенные из культуры человеческих фибробластов, зараженных цитомегаловирусом (штамм AD-169). В качестве планшетов были использованы разборные планшеты фирмы «Nunk» (Дания). В качестве контрольных в обеих тест-системах использованы контрольный положительный образец (K+), контрольный «пороговый» образец (Kпор) и контрольный отрицательный образец (К-). Образцы K+ и Kпор — это образцы сывороток с известными титрами IgM- или IgG-антител к ЦМВ. Такая комплектация позволяет обеспечивать не только «внутренний» контроль, т. е. контроль правильности постановки, но также обходиться без расчетов так называемых «пороговых» значений оптической плотности (ОПпор) при учете результатов анализа, используя как ОПпор значение ОП в лунках с Kпор. Кроме того, известные титры K+ и Kпор обеспечивают возможность расчетной или графической оценки титра антител в исследуемых образцах по соотношению Ig(титрОПпор) х (ОПобр/ОПпор). В качестве конъюгата в обеих тест-системах использованы антитела диагностические мышиные против иммуноглобулинов человека (классов IgM и IgG соответственно), меченные пероксидазой. Помимо этих специфических компонентов, в тест-системы входят раствор индикаторный (стабилизированный раствор хромогена — тетраметилбензидина) и обычные для большинства ИФТС вспомогательные растворы — концентрат отмывающего раствора, содержащий детергент, буферный раствор для разведения сывороток и стоп-реагент (кислота серная, раствор 1 моль/л). В набор тест-системы для выявления антител класса IgM, кроме того, входит блокирующий раствор, который вводится в исследуемые образцы для устранения в результатах ИФА интерференции IgG-антител, ревматоидного фактора и антинуклеазных антител. Все компоненты тест-систем, кроме концентрата отмывающего раствора, готовы к работе и отличаются друг от друга окраской или цветом упаковки. Время анализа в обеих тест-системах (с учетом 30-минутной обработки блокирующим раствором образцов, исследуемых на наличие IgM-антител) составляет 1 ч 45 мин. Реакция проводится при комнатной температуре. Для оценки чувствительности и специфичности тест-системы «ИФА-ЦМВ-IgG» был проведен ИФА сывороток панели С1-С30 («Pasteur Institut Athen»). Параллельно ИФА был проведен иммунофлюоресцентный анализ тех же сывороток на антитела класса IgG. Результаты, полученные при этом, представлены в табл. 22. Они показывают полное совпадение оценок, полученных указанными методами. При исследовании 52 сывороток панели «QC Viro-Immun» на наличие IgG-антител к ЦМВ в РИФ и ИФА с использованием тест-систем «Biotest Anti-HCMV recombinant IgG-ELISA» («Biotest») и «ИФА-ЦМВ-IgG» между обеими тест-системами не было выявлено каких-либо заметных различий. Оценки, полученные в обеих тест-системах (данные представлены в табл. 23—25), вполне удовлетворительно согласовывались с результатами РИФ и, соответственно, между собой. Столь же высокое совпадение результатов было получено при испытаниях тест-системы «ИФА-ЦМВ-IgG» в сравнении с тест-системой «CMV IgG EIA-recomb» (фирмы «Roche», Швейцария), проведенных Экспертной лабораторией МЗ РФ СПб ГУЗ «Городской диагностический центр (вирусологический)» Комитета по здравоохранению Правительства Санкт-Петербурга. Была показана 100 %-я чувствительность и специфичность тест-системы «ИФА-ЦМВ-IgG» при ее испытаниях в ГИСК им. Л. А. Тарасевича на сыворотках стандартной панели, содержащих и не содержащих анти-IgG к ЦМВ. С сыворотками панели С1-С30 («Pasteur Institut Athen») после сорбции в них IgG-антител были затем проведены ИФА и РИФ для оценки наличия антител класса IgM к ЦМВ. При этом для постановки ИФА, кроме тест-системы «ИФА-ЦМВ-IgM», была использована аналогичная тест-система «Biotest Anti-HCMV IgM-plus-ELISA» (фирма «Biotest», Германия). Результаты, полученные при этом, представлены в табл. 26—28. Из представленных данных видна высокая степень совпадения оценок, полученных в РИФ и ИФА с использованием тест-системы «ИФА-ЦМВ-IgM» и значительные расхождения в оценках тех же сывороток в РИФ и ИФА с использованием тест-системы «Biotest Anti-HCMV IgM-plus-ELISA», а также при сопоставлении результатов ИФА с использованными тест-системами. Эти расхождения могут быть связаны с тем, что в тест-системе сравнения иммуносорбент приготовлен на основе рекомбинантных антигенов ЦМВ, хотя, с другой стороны, тест-системы «ИФА-ЦМВ-IgG» и «Biotest Anti-HCMV recombinant IgG-ELISA» таких расхождений не показали. Кроме того, проведенные в разные сроки и в различных лабораториях сравнительные испытания тест-системы «ИФА-ЦМВ-IgM» и тест-систем «CVM IgM EIA recomb» (фирмы «Roche», Швейцария) и «ВектоЦМВ-IgM-стрип» (фирмы «Вектор-Вест», Новосибирск), в которых также используются рекомбинантные антигены ЦМВ, также дали совпадение оценок в 95 % случаев (58 образцов из 61 и 41 образец из 43 соответственно). Дополнительные расширенные исследования для определения чувствительности и специфичности тест-систем «ИФА-ЦМВ-IgG» и «ИФА-ЦМВ-IgM» позволили установить, что чувствительность обеих тест-систем составляет 100 %, а специфичность — 100 % для «ИФА-ЦМВ-IgG» и 93 % для «ИФА-ЦМВ-IgM». Определение индекса авидности. Тест-системы «ИФА-ВПГ-1+2-IgС-авидность» и «ИФА-ЦМВ-IgС-авидность», разработанные ЗАО «ЭКОлаб», предназначены для определения индекса авидности иммуноглобулинов класса G к вирусу простого герпеса (ВПГ-1, ВПГ-2) и ЦМВ соответственно в сыворотке (плазме) крови человека методом непрямого ИФА на твердофазном носителе. Принцип действия тест-систем основан на том, что иммуноглобулины класса G связываются с антигеном соответствующей инфекции, сорбированным на поверхности лунок полистиролового планшета. Под действием диссоциирующего раствора комплексы «антиген — низкоавидные IgG» диссоциируют; ее степень зависит от авидности IgG. Недиссоциированные комплексы связываются с конъюгатом — антителами против IgG человека, меченными пероксидазой хрена. Далее, после добавления индикаторного раствора (хромоген — тетраметилбензидин), в результате ферментативной реакции реакционная смесь в лунках планшета окрашивается пропорционально концентрации антител класса G, связанных с конъюгатом. Реакция останавливается добавлением стоп-реагента. Интенсивность окрашивания (оптическая плотность) регистрируется с помощью спектрофотометра. | |
|
| |
| Всего комментариев: 0 | |