13:04 Вакцинопрофилактика герпеса | |
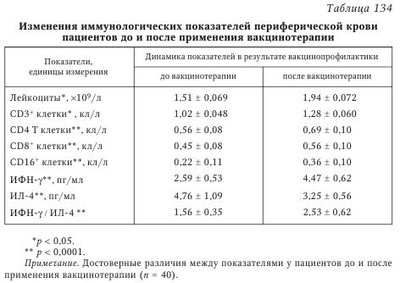
Терапия больных РГИ представляет определенные трудности в связи с многообразием клинических форм заболевания, пожизненной персистенцией вирусов герпеса, значительной стоимостью эффективных противогерпетических средств, наличием спорных вопросов в понимании отдельных звеньев патогенеза болезни. Нередко противовирусные ХП надежно обрывают рецидив герпеса, подавляют репродукцию внеклеточно расположенного ВПГ, но не влияют на вирусы в невральных ганглиях и не снижают частоту рецидивов. При повторном использовании противовирусных средств возможно развитие резистентности к базовому ХП, особенно у лиц со сниженным иммунитетом. Важным этапом лечения и профилактики РГИ является использование специфических герпетических вакцин (ГВЦ). Цель вакцинации — активация клеточного иммунитета, его иммунокоррекция и специфическая десенсибилизация организма. Вакцины чаще используют в период клинико-иммунологической ремиссии. Редко начинают вакцинацию (совместно с индукторами интерферона) в начальный период рецидива. В разных странах мира применяют живые, инактивированные (цельновирионные и субъединичные) и рекомбинантные вакцины. За последние 40 лет 24 коллектива врачей из пяти европейских стран применили 12 модификаций таких вакцин на десятках тысяч больных с рецидивирующими ГВИ. Живые ГВЦ индуцируют активный и длительный иммунитет, широкий спектр защитных реакций. Однако выявленная онкогенность ВПГ, отсутствие простых и надежных маркеров ее обнаружения и удаления онкогена из ДНК вируса не позволяют использовать живые вакцины при лечении ГИ у человека. Разработка инактивированных герпетических вакцин (ИГВ) началась в 1921 г. В США использовались ИГВ, созданные из штаммов ВПГ-1, выращенного в культуре почек кролика. В конце 1960-х гг. в Западной Европе применялись ИГВ Lupidon H (ВПГ-1) и Lupidon G (ВПГ-2), последняя оказалась эффективной в 85 % случаев при лечении ГГ. В связи с широким распространением ВПГ-1 среди населения считали целесообразным применение вакцинации с целью лечения и иммунокоррекции. Учеными НИИ вирусологии им. Д. И. Ивановского в 60-е годы прошлого столетия была создана первая в мире ИГВ против ВПГ-1 и ВПГ-2 типов, которая используется в лечебной практике с 1985 г. и обладает хорошим терапевтическим эффектом (Санкт-Петербургский институт вакцин и сывороток, СПбИВС). К настоящему времени, кроме базовой, разработано несколько схем вакцинации: 1. При офтальмогерпесе вакцинацию проводят в соответствии с методическими рекомендациями «Диагностическое и лечебное применение противогерпетической поливакцины у больных офтальмогерпесом», утвержденными Главным управлением лечебно-профилактической помощи Минздрава СССР 02.09.1984 г. 2. Центральным научно-исследовательским кожно-венерологическим институтом МЗ РФ предложена следующая схема лечения — герпетическую вакцину вводят по 0,2 мл во внутреннюю поверхность предплечья 1 раз в неделю, курс 5 инъекций. Ревакцинация проводится каждые 6—8 мес. по той же схеме. 3. Если рецидив ГИ возник в период ремиссии, то рекомендуют аллергометрическую методику противорецидивного лечения. При этом одномоментно внутрикожно вводят герпетическую вакцину в 5 точек внутренней поверхности предплечья (на расстоянии 5—6 см) в объеме 0,2 мл (разведенная 1:1000—1:100—1:10 — цельная) и стерильного физиологического раствора (контроль). Реакцию немедленного типа учитывают через 20 мин после введения вакцины, а замедленного типа — через 24 и 48 ч. Внутрикожную пробу считают положительной при наличии разницы в 5 мм и более между максимальными размерами зоны гиперемии кожи в местах введения герпетического и контрольного антигенов. Вакцинацию проводят пороговыми разведениями вакцины (наибольшее разведение, которое обусловливает положительную внутрикожную пробу), начиная с 0,1 мл, постепенно переходят на следующие разведения вакцины (0,2—0,4—0,8 мл), а затем на цельную вакцину в объеме 0,01—0,1 и 0,02—0,2 мл с интервалом в 2—3 дня. 4. В. М. Гранитов (2001) рекомендует вводить герпетическую вакцину по 0,2 мл через 2—3 дня, курс 10 инъекций. Появление герпетических высыпаний в период вакцинотерапии не является противопоказанием для дальнейшего лечения. В этом случае необходимо увеличить промежутки между инъекциями до 5—10 дней. Каждые 6—8 мес. проводится ревакцинация из 5 инъекций с частотой 1 раз в неделю, необходимо 3—5 таких курсов. 5. В случае часто рецидивирующего герпеса (рецидивы 1 раз в месяц и чаще) на фоне иммунодефицитных состояний вакцинация начинается после завершения иммунокоррекции 1 раз в 7—14 дней в количестве 5 инъекций с ревакцинациями 1 раз в 6—8 мес. Снижение качества жизни, угнетение основных защитных реакций у больных рецидивирующим герпесом и, как следствие, ухудшение здоровья населения в последние годы привело к снижению эффективности вакцинации. Так, применение вакцинотерапии по базовой методике у больных с РГГ в период стойкой ремиссии сопровождалось активацией инфекционного процесса у 51,3 % пациентов, у 28,9 % отмечено лишь снижение тяжести объективных и субъективных проявлений рецидива ГИ и удлинение ремиссии. Лишь у 19,8 % больных получены хорошие результаты. Т. Б. Семенова использовала стандартную ГВЦ по базовой схеме у двух групп больных ГГ: в 1-й группе ГВЦ вводили 1 раз в 4 дня, а во 2-й — 1 раз в 20 дней. После лечения у больных 1-й группы отмечалась негативная иммунологическая динамика, более редкое введение вакцины позволило избежать ее супрессивного действия. В целом, в результате вакцинотерапии происходит стимуляция функциональной активности иммунокомпетентных клеток. В то же время использованная вакцина не оказывает достаточного стимулирующего влияния на клеточный иммунитет больных с часто рецидивирующими и осложненными формами ПГ. Следует напомнить, что именно состояние Т-клеточного звена иммунитета во многом определяет характер, течение и исход рецидивирующего герпеса. Заслуживает внимания сообщение из Англии об итогах клинических испытаний вакцины Simplirix против ВПГ-2 у женщин с часто рецидивирующим ГГ (Национальный институт исследования аллергий и инфекций — National Institute of Allergy and Infectious Diseases (NIAID), 2010). До клинических испытаний было известно, что вакцина имеет серьезные ограничения, но все-таки может оказывать эффект у женщин, которые на момент испытаний не были инфицированы ВПГ-1. Возможно, иммунитет против ВПГ-1 обеспечивает некоторую протекцию против ВПГ-2, что в итоге могло завуалировать собственный эффект от вакцины против ВПГ-2. Такой вывод сделан после того, как было показано, что вакцина в 70 % случаев эффективна у ВПГ-1-негативных женщин. На основании этого исследовательский центр вакцин американского Национального института исследования аллергий и инфекций (NIAID) решил инвестировать 27,6 млн долларов США в масштабное клиническое испытание, включив в него ВПГ-1 и ВПГ-2-негативных женщин. Считали, что вакцина будет активировать гуморальный иммунитет, таким образом оказывая профилактический эффект. После 8 лет исследований вакцины Simplirix на 8323 женщинах с РГГ (возраст 18—30 лет) в США и Канаде не получено позитивного результата. Пока исследователи ищут объяснения полученным результатам, многие из них констатируют снижение интереса к вакцине против ВПГ-2 в деловых кругах фармкомпаний. Опыт использования герпетической вакцины «Герповакс». В 1994 г. на предприятии Санкт-Петербургского НИИ вакцин и сывороток освоено производство герпетической культуральной сухой ИГВ, которая выпускается по усовершенствованной технологии и имеет коммерческое название «Герповакс». Вакцину «Герповакс» готовят на основе репродуктивных и иммунологически компетентных штаммов ВПГ (ВПГ-1) (штамм УС) и ВПГ-2 (штамм BH) антигенных типов, предоставленных профессором И. Ф. Баринским. Субстратом для получения вакцины служит первичная культура клеток куриных фибробластов. Разработаны условия повышения репродуктивной активности посевных штаммов ВПГ, очистки вакцины и стабилизации полуфабрикатов. Инактивацию герпетической вакцины проводят формалином, который улетучивается в процессе лиофилизации. Вакцина «Герповакс» очищена от балластных белков, не содержит человеческого альбумина, что, по мнению авторов, обеспечивает снижение токсичности и аллергических потенций вакцины. Базовая схема вакцинации ИГВ: 0,2 мл вакцины вводят внутрикожно в сгибательную поверхность предплечья. Цикл вакцинации состоит из 5 инъекций, которые проводятся с интервалом в 4 дня. Основной курс включает 2 цикла с 10-дневным перерывом между ними. Для стойкого профилактического эффекта необходимо проведение повторных курсов вакцинации через 3—6—12 мес. Терапевтическое действие культуральной ИГВ «Герповакс» было подтверждено в процессе выборочного наблюдения и комплексного лечения больных, страдавших различными формами рецидивирующей ГИ. Всего под наблюдением находился 2391 больной. Более всего клинические проявления герпеса имели место у лиц в возрасте от 28 до 45 лет, а преобладающей формой инфекции был ГГ, которым страдали 44 % наблюдаемых больных. Из числа обратившихся за врачебной помощью несколько меньше было лиц с лабиальным герпесом (35 %), офтальмогерпесом, кожными высыпаниями и другими формами ГИ. Лечение больных было комплексным и направленным на увеличение длительности ремиссии. Этого достигали применением для лечения ХП, иммуномодуляторов, поливитаминов, препаратов ИФН и использованием инфракрасного лазера. Через 2 нед. после перехода болезни в стадию ремиссии начинали лечение ГВЦ в соответствии с инструкцией по применению. Оценку эффективности лечения определяли по уменьшению клинических проявлений ГИ и отсутствию вирусного антигена ВПГ в анализах от больных по данным ПЦР через 3, 6 и 12 мес. после проведенной терапии. Суммируя опыт лечения больных ГИ за 10 лет наблюдения, следует отметить, что эффективность ремиссии продолжительностью 1,5—3 года достигается в 85 % случаев при комплексной терапии с использованием ГВЦ. Полученные результаты позволяют считать возможным успешное лечение герпеса с применением специфической противогерпетической вакцины. Необходима дальнейшая разработка новых, более эффективных схем вакцинации, которые, с одной стороны, не должны приводить к активации ГИ, с другой — должны быть просты и удобны к применению в амбулаторных условиях. Одна из таких схем предложена авторами. Под наблюдением находилось 90 больных часто рецидивирующим ГГ. Женщины в возрасте 23—38 лет имели по 10—12 рецидивов ГГ в год, длительность болезни составляла от 1,5 до 6 лет. Рецидивы чаще возникали во время или после месячных. Герпетическая сыпь чаще локализовалась на больших половых губах (46,7 %) и в области промежности (26,7 %), реже — в области преддверия влагалища (17,8 %) и малых половых губ (8,8 %). Вакцинотерапия начиналась спустя 2 нед. после окончания рецидива под тщательным клинико-иммунологическим контролем. В работе использовали противогерпетическую культуральную сухую ИГВ «Герповакс» (СПб ИВС) по авторской методике. Готовили рабочее разведение (1 : 10—1 : 10000), затем 0,2 мл вакцины вводили асептично внутрикожно во внутреннюю поверхность предплечья, начиная с разведения 1:10000 и 1 : 1000. Через 24 ч после введения учитывали местную реакцию: рабочим разведением считали то, после введения которого появлялась зона гиперемии от 5 до 15 мм. Вакцинацию начинали через 72 ч и более, цикл состоял из 5 инъекций с интервалом 1—2 нед. Через 2—4 нед. такой цикл вакцинации повторяли. Результаты вакцинотерапии считались хорошими (62,2 % вакцинированных), если в течение 6 мес. после вакцинации не было рецидивов ГГ, удовлетворительными (29 % вакцинированных), если за этот же период было не более 2 рецидивов (сроки ремиссии увеличились в 3—3,5 раза) и неудовлетворительными (8,8 % вакцинированных) при неизменной частоте и клинической картине рецидивов. Таким образом, клиническая эффективность предложенной схемы вакцинотерапии больных с часто РГГ составила 91,2 %. Улучшались иммунологические показатели вакцинированных: достоверно увеличивалось содержание EK (CD16+ клеток), увеличивалась функциональная активность лимфоцитов периферической крови в РБТЛ (спонтанная и индуцированная фитогемагглютинация), восстанавливалась способность лейкоцитов синтезировать эндогенные ИФН-а/в, обладающие выраженной противовирусной активностью. В Болгарии изготовили культуральную ИГВ, убитую формалином. Вакцина оказывала иммуномодулирующий эффект, стимулировала активность Т-клеточного звена иммунитета и (в меньшей степени) активность макрофагов. Значительное улучшение после курса ИГВ (5 внутрикожных инъекций с интервалом 7 дней) отмечено при лечении ГГ у 73—93 % больных. Выявлен синергидный эффект при использовании болгарской вакцины в сочетании с лазеротерапией. Авторы данного руководства и другие исследователи также использовали болгарскую сухую моновалентную герпетическую ИГВ (ВПГ-1 и ВПГ-2). Была показана ее более высокая эффективность в сравнительных испытаниях с вакциной, производившейся ранее ИВС г. Одессы. Схема вакцинации включала 6 инъекций с интервалом в 20 дней. После 1 года наблюдений значительное улучшение отмечено у 83 % вакцинированных одесской дивакциной (ВПГ-1 и ВПГ-2), у 87 % — после применения болгарской герпетической вакцины ВПГ-1 и у 90 % лиц с ГГ, иммунизированных болгарской вакциной ВПГ-2. Имеются данные о том, что с соответствующим адъювантом рекомбинантные вакцины против ВПГ вызывают хороший гуморальный и клеточно-опосредованный иммунитет у серонегативных людей. Эффективность лечебной иммунизации серопозитивных больных с целью уменьшения частоты рецидивов ГИ имеет не столь однозначную оценку. Так, завершенные исследования по апробации рекомбинантной ВПГ-2 gpD вакцины у больных ГГ показали небольшой, но достоверный эффект в уменьшении частоты рецидивов ГИ. Считаются перспективными разработки ГВЦ на основе создания искусственных мутантов штаммов ВПГ-1, ВПГ-2 и ЦМВ, из генома которых удален ген инфекционности (gH-ген) при сохранении генов, которые кодируют иммуногенные gB и gD. Другой группой фирм предложена субъединичная вакцина против ВПГ, рекомендованная для использования у серонегативных лиц, что ограничивает ее применение. В настоящее время в мире разрабатываются и испытываются различные ГВЦ, в основном рекомбинантные. Пептидные вакцины могут быть индивидуализированы с типом главного комплекса тканевой совместимости (МНС) пациентов и поэтому, на наш взгляд, могут быть наиболее перспективны. В ближайшее время ожидается появление целого ряда пептидных и ДНК-опосредованных противогерпетических вакцин. По-видимому, наиболее эффективным может быть сочетанное применение ГВЦ с интерферонами и индукторами интерферонов, а также специфическими иммуноглобулинами. В 2003 г. сотрудники ЗАО «Фирма “Витафарма”» (Москва) освоили производство и внедрили в медицинскую практику новую вакцину против простого герпеса «Витагерпавак», впервые разработанную в России (в мировой практике подобного рода вакцин нет). Вакцина «Витагерпавак» представляет собой лиофилизированный инактивированный антиген вируса ПГ типов 1 и 2, выращенного на перевиваемой линии клеток почек зеленой мартышки — Vero В, разрешенных ВОЗ в качестве субстрата для производства вирусных вакцин. В состав вакцины также входят: стабилизатор — сахароза, в конечной концентрации 75 мг/мл и желатоза, в конечной концентрации 10 мг/мл, остаточный формальдегид (инактиватор вируса), не более 200 мкг/мл, следы антибиотика гентамицина сульфата, не более 40 мкг/мл. Лиофилизированная вакцина представляет собой аморфную массу цветом от желтого до розового, гигроскопичную. Выпускается во флаконах по 0,3 мл, предназначена для внутрикожного введения (1 прививочная доза — 0,2 мл), в упаковке — 5 флаконов и инструкция по применению. Срок годности — 2 года. Вакцина с истекшим сроком годности использованию не подлежит. Вакцина стерильна, нетоксична, не пирогенна и безопасна. Транспортировка и хранение осуществляются в соответствии с Санитарными правилами (СП 3.3.2.1248—03 «Условия транспортирования и хранения медицинских иммунобиологических препаратов») при температуре от 2 до 8 °С. При использовании вакцины следует руководствоваться инструкцией по ее применению. Инъекции вакцины «Витагерпавак» хорошо переносятся больными. Вакцину применяют не ранее, чем через 5 дней после исчезновения клинических симптомов ГИ. Препарат вводят внутрикожно в область внутренней поверхности предплечья в разовой дозе 0,2 мл. Иммуногенность. Вакцинация хронически инфицированных ВПГ людей сопровождается усилением в 3—4 раза специфических реакций Т-клеточного иммунитета (PБTЛ), реакции задержки миграции лимфоцитов (PЗMЛ), тогда как высокий уровень В-клеточных реакций (титр антител, выявляемый в реакциях нейтрализации и связывания комплемента) остаются неизменными. Усиление PБTЛ на антигены ВПГ сохранялось в течение 45 дней после курса внутрикожной вакцинации (5 инъекций). Сравнительное изучение активности реакций Т-клеточного иммунитета у вакцинируемых показало усиление специфической Т-киллерной активности лимфоцитов. Вакцинация способствует стимуляции высокой активности НК-клеток и прекращению вирусемии. Непосредственно после вакцинации и в отдаленные сроки (6 мес. после вакцинации) у обследованных методом ПЦР больных вирусемию не обнаруживали, а при использовании МФА ее выявляли в лейкоцитах крови в 6 из 50 случаев. У больных офтальмогерпесом проведение 2 курсов вакцинации в год способствовало повышению уровня IgA в слезной жидкости и не влияло на уровень специфических IgM и IgG в сыворотке крови. Вакцина «Витагерпавак» уже при первой вакцинации дает значительный иммунокорригирующий эффект, снижая степень иммунных расстройств с 3-й и 2-й степени до 1-й. Через 6 мес. после вакцинации иммунные расстройства соответствуют 1-й степени. Таким образом, проведенные многолетние клинико-вирусологические исследования по разработке и внедрению в практику инактивированной формалином дивакцины против ВПГ-1 и ВПГ-2 показали ее выраженную активность в профилактике рецидивов ГИ, обусловленную активацией реакций клеточного иммунитета и специфической десенсибилизацией. Показания к применению. Вакцинации подлежат: — больные РГИ (с клиническими проявлениями) и обострениями болезни (рецидивами) чаще 3 раз в год; — пожилые люди — на общих основаниях; — ВИЧ-инфицированные пациенты в 1-й и 2-й стадии болезни — до развития активной симптоматики СПИДа. Подбор пациентов и проведение вакцинации осуществляет лечащий врач, ответственный за проведение вакцинопрофилактики. Контроль за соблюдением условий вакцинации, а также за транспортированием, хранением, учетом вакцины и возможными нежелательными реакциями при проведении вакцинации возлагаются на органы, осуществляющие государственный санитарно-эпидемиологический надзор. Противопоказания к применению вакцины «Витагерпавак»: — герпетическая инфекция в активной стадии (рецидив). Вакцинацию проводят не ранее, чем через 5 дней с момента исчезновения клинических проявлений, при офтальмогерпесе — не ранее чем через 1 мес.; — острые инфекционные и неинфекционные заболевания; — хронические заболевания в стадии обострения или декомпенсации; — злокачественные новообразования; — беременность; — аллергия к гентамицину и другим антибиотикам группы аминогликозидов; — наличие активной симптоматики СПИДа. Побочные реакции. После введения вакцины в отдельных случаях могут развиваться местные и общие (незначительное повышение температуры, проходящее без лечения) реакции. Местная реакция: гиперемия кожи диаметром до 2 см в течение первых суток и слабое кратковременное жжение являются нормальной реакцией организма на введение препарата. При возникновении более выраженных местных и общих реакций или при обострении основного заболевания вакцинацию следует прекратить. Вакцинация может быть продолжена после полного исчезновения клинических проявлений общей реакции на введение вакцины. Все случаи более выраженных местных и общих реакций у больного должны быть обследованы врачом и занесены в медицинскую документацию. Пятилетний опыт применения вакцины «Витагерпавак» на территории Российской Федерации выявил высокую эффективность специфической профилактики рецидивов ГИ. Вакцина «Витагерпавак» была использована согласно инструкции по применению при лечении 60 пациентов с часто рецидивирующей формой кожного и генитального герпеса: с кожной формой ГИ было 43 % пациентов, с генитальной — 57 % больных. Реакций на введение вакцины не было. В течение всего срока наблюдения (6 мес.) не было рецидивов заболевания у 64 % больных, в том числе у 27 % с кожной формой ГИ и у 37 % с генитальным герпесом. Частота рецидивов уменьшилась с 4—9 раз в год до 2—3 раз в год, длительность рецидива — с 3—8 дней до 2—3 дней. Увеличение сроков ремиссии с 2 до 6 мес. наблюдалось у больных с кожной формой ГИ в 61 % случаев, с генитальной формой — в 64 %. Клинически тяжело могут протекать вирусные заболевания глаз (герпес, аденовирусы), причем поражаются все среды глаза, зрительный нерв; возможно снижение остроты зрения вплоть до полной слепоты. При тяжелом течении офтальмогерпеса врачам бывает трудно добиться выздоровления пациента в течение 2—3 мес. Интересными оказались результаты, полученные профессором А. А. Каспаровым (НИИ глазных болезней РАМН). Вакцина «Витагерпавак», примененная для противорецидивной терапии, показала достоверный терапевтический эффект. При офтальмогерпесе лечение вакциной начинают через 1 мес. после окончания рецидива. Инъекции проводят с интервалом в 1—2 дня, всего 5 инъекций, ревакцинацию — через 6 мес. Содержимое флакона растворяют в 0,3 мл воды для инъекций, затем флакон встряхивают до полного растворения содержимого. Растворенный препарат должен представлять собой слегка опалесцирующую жидкость розового цвета. Из 114 больных офтальмогерпесом с часто рецидивирующими формами заболевания рецидивы герпеса полностью прекратились у 71 больного (63 %); частота рецидивов стала достоверно меньше у 32 (27 %) пациентов и не изменилась у 11 (10 %). Статистическая обработка результатов показала снижение частоты рецидивов в 5 раз и уменьшение длительности рецидивов в 3,2 раза в расчете на 1 больного, страдающего герпетическими кератитами, иридоциклитами и кератоиридоциклитами. Внутрикожное введение вакцины больным офтальмогерпесом в «холодном» периоде заболевания в виде 2 курсов вакцинации в год, существенно не влияя на уровень специфических IgM и IgG в сыворотке крови, увеличило уровень IgA в слезной жидкости. Сравнительное изучение активности реакций Т-клеточного иммунитета показало их усиление, выявляемое у вакцинируемых в PБTЛ на ВПГ и в РЗМЛ на этот же антиген. При исследовании методом ПЦР и МФА крови больных герпесом было выявлено, что ИГВ, используемая интрадермально, устраняла вирусемию у всех 27 больных ГГ и у 71 больного (63 %) офтальмогерпесом. В связи с этим профессором А. А. Каспаровым с соавторами было предложено использовать герпетическую ИГВ для диагностики герпетического иридоциклита, а также герпетических поражений увеального тракта и ретины. Новый клинический опыт применения вакцины «Витагерпавак», обобщенный в методических рекомендациях (MP 3.3.3.0002—10 «Иммунизация вакциной (герпетическая культуральная инактивированная сухая) для профилактики рецидивов инфекции, обусловленной вирусами простого герпеса 1 и 2 типов»). Результаты изучения противорецидивной терапии, проведенной за период от 3 до 5 лет у 3000 больных с часто рецидивирующими формами герпетической инфекции, показали, что рецидивы заболевания полностью прекратились у 1890 больных (63 %), стали возникать достаточно реже у 810 (27 %) пациентов и частота рецидивов осталась прежней у 240 (8 %) больных. На примере изучения герпетических кератитов, иридоциклитов и кератоиридоциклитов показано, что в расчете на 1 больного частота возникновения рецидивов заболевания снижается в 3,2 раза после проведения вакцинации. На кафедре кожных и венерических болезней Азербайджанского медицинского университета (г. Баку) показано преимущество применения вакцины «Витагерпавак» (Москва) перед используемой в практике симптоматической терапией. У 61 больного ГГ с частотой рецидивов от 5 до 10 раз в год, результаты вакцинации показали, что через 6 мес. 38 человек (62,3 %) прекратили лечение в связи с наступившим улучшением, у 20 человек (52 %) из них симптомы болезни полностью отсутствовали, у 18 человек (48 %) наблюдалось значительное улучшение. Длительность течения рецидивов уменьшилась в среднем с 8 дней до 2—3 дней, при этом рецидивы носили абортивный характер и выражались в снижении интенсивности субъективного и объективного симптомокомплекса продромального периода и периода вирусемии. В исследованиях Л.А. Марченко (Научный центр акушерства, гинекологии и перинатологии РАМН), проведенных у 200 больных РГГ, уже через 6 мес. после вакцинации показано: у 31,5 % заболевших наблюдалось значительное увеличение межрецидивного периода в 3 раза (до 7 мес.), у 58 % пациентов ремиссии увеличились в 1,5—2 раза и только у 10,5 % больных терапевтический эффект был мало выражен или отсутствовал. Из 200 больных 77 были обследованы через 2 года после регулярной (2 раза в год) вакцинации. При этом у 40 больных (52 %) клинические симптомы рецидивирующей ГИ полностью отсутствовали. Подавляющее большинство из 200 больных прекратило лечение в связи с наступившим улучшением в результате вакцинации. По данным Н. С. Потекаева и М. А. Самгина (кафедра кожных и венерических болезней Московской государственной медицинской академии им. И. М. Сеченова), после регулярного применения вакцины у 233 больных РГГ наступило удлинение периодов ремиссии заболевания до 1—3 лет. Этими авторами через 5 лет после регулярной 4-летней вакцинации обследовались 88 больных: полное излечение наблюдалось у 42 человек; значительное улучшение — у 24 человек, что соответствовало 75 % больных рецидивирующей ГИ. Таким образом, вакцина «Витагерпавак» по результатам доклинического и клинического изучения обладает хорошей переносимостью, а также выраженной лечебной эффективностью. При внедрении вакцины «Витагерпавак» (Москва) в практику здравоохранения были проведены шифрованные клинические испытания по утвержденной Комитетом по этике «Программе государственных клинических испытаний лекарственного препарата „Витагерпавак”, вакцина герпетическая культуральная инактивированная сухая». Далее изучались результаты вакцинации: внутрикожное введение вакцины не вызывало каких-либо выраженных общих или местных реакций, токсических проявлений и неблагоприятных побочных эффектов. После вакцинотерапии, в период, равный 6 месяцам, у большинства больных отмечалось отсутствие клинических проявлений рецидивов хронической ГИ, отмечено увеличение длительности ремиссии, а также уменьшение длительности рецидивов. Филогенетический анализ изменений генетических структур вирусов ВПГ-1 (штамм УС) и ВПГ-2 (штамм BH), содержащихся в вакцине «Витагерпавак» (Москва), культивированных на клетках Verо В, показал максимальную схожесть последовательностей вирусов с последовательностями ВПГ из международной базы данных Gen-Bank (Япония). Штаммы УС и BH, адаптированные к линии клеток Vero В, имели меньше отличий от международных образцов, депонированных последовательностей референс-штаммов, чем штаммы, культивированные на других субстратах, в том числе фибробластов куриных эмбрионов. Максимальное сохранение генетической последовательности ДНК вируса в вакцине «Витагерпавак» обеспечивает высокую специфическую активность препарата. Е. Г. Коритво в клинике современных технологий «Садко» (Н. Новгород) с 2003 г. в комплексном лечении больных с рецидивирующей ГИ использовал вакцину «Витагерпавак». Пролечено 739 больных в возрасте от 22 до 46 лет с рецидивирующей ГИ: 501 пациент с ГГ и 238 пациентов с лабиальной формой инфекции, рецидивы наблюдались от 5 до 14 раз в год. Вакцинация проводилась согласно инструкции по применению. Всего 615 пациентов прошли 2 курса ревакцинации (через 6 и 12 мес.). Эффективность вакцинотерапии оценивалась по увеличению длительности ремиссии после проведенного курса (однократного или с двумя ревакцинациями). У 615 (83 %) пациентов после лечения в течение 2 лет не было рецидивов герпеса. У 73 (9,8 %) больных сократилась частота рецидивов до 2—3 в год. После вакцинации рецидивы носили абортивный характер, были менее продолжительными и характеризовались снижением интенсивности субъективных и объективных признаков. Нежелательных побочных реакций общего или местного характера сразу после введения вакцины не было. Применение вакцины «Витагерпавак» показало высокий терапевтический эффект. ЗАО МНПО «Клиника „Движение”» с 1992 г. является крупным многопрофильным медицинским учреждением г. Волгограда, где лечат больных с гинекологическими, дерматологическими, стоматологическими, аллергическими и другими заболеваниями. Вакцина «Витагерпавак» применяется с 2006 г. Проведена вакцинация 712 больных с часто РГГ (5—8 рецидивов в год), из них 398 женщин и 314 мужчин в возрасте от 18 до 52 лет с давностью заболевания от 3 до 20 лет и более. Вакцинация проводилась согласно «Инструкции по применению „Витагерпавак” (лиофилизат для приготовления раствора для внутрикожного введения)», утвержденной Главным государственным санитарным врачом РФ Г. Г. Онищенко 26 июня 2007 г. № 01—11/110—07, по схеме — 0,2 мл внутрикожно с частотой 1 инъекция в 7—10 дней, на курс 5 инъекций. Эффективность вакцинотерапии оценивалась по увеличению длительности ремиссии после первого курса вакцинации. Увеличение сроков межрецидивного периода в 4 раза наблюдалось у 620 больных (87 %), в 2—2,5 раза — у 73 пациентов (10,2 %). При этом у всех больных при рецидивах клинические проявления были значительно менее выражены. Из 712 больных у 457 пациентов (64,1 %) в течение 3 лет не было повторных рецидивов (отсутствие клинических симптомов), у 102 больных (14,3 %) рецидив возник через 3—4 года, у 153 больных (21,5 %) в течение 2 лет был только один рецидив. Таким образом, данная вакцина показала высокий терапевтический эффект, который не вызывает сомнений. Опыт использования вакцины «Витагерпавак» для профилактики РГГ с монотонным типом рецидивирования. Лечение больных РГГ сопряжено с определенными трудностями из-за разнообразных механизмов патогенеза заболевания, высокой стоимости противогерпетических ХП, которые, быстро и эффективно купируя острые проявления ГГ, не предотвращают повторное реци-дивирование и не снижают частоту рецидивов болезни. Для повышения эффективности лечения необходимо включать иммунобиологические препараты, способствующие коррекции иммунологического статуса больного, а также патогенетические средства. Авторами данного руководства было пролечено 100 молодых женщин с так называемым «менструальным герпесом», характеризующимся монотонным рецидивированием с ежемесячными (как правило) обострениями. Выделено 4 группы по 25 человек в зависимости от характера получаемой терапии: монотерапия фамвиром, фамвир в сочетании с одним из препаратов — амиксин, циклоферон или виферон в свечах. Основными целями лечения рецидивирующей ГИ считают не только быстрое и эффективное купирование острых проявлений герпеса, но и стабилизацию течения патологического процесса с прекращением рецидивирования или, по крайней мере, снижением частоты рецидивов и увеличением длительности периода ремиссии. Данное лечение рассматривалось как предварительный (первый) этап, за которым последует специфическая профилактика рецидивов ГГ с использованием впервые инактивированной герпетической вакцины (ИГВ) «Витагерпавак» для данной категории больных (второй этап). Применение препарата ИГВ «Витагерпавак» осуществлялось на основании аллергометрической методики согласно Методическим рекомендациям «Диагностика, клинические особенности и лечение внутриглазного герпеса» (утверждены М3 СССР 13.10.1989 г.). Перед применением препарата для определения порогового разведения проводится очаговая аллергическая проба. Используется одномоментное внутрикожное введение ИГВ на внутренней поверхности предплечья в пяти точках на расстоянии 5—6 см, начиная с разведения 1 : 1000, в дальнейшем увеличивая концентрацию препарата до 1:100 и 1:10 нативной поливакцины и контроля (стерильного изотонического раствора в объеме 0,002 мл). Реакцию учитывают через 20 мин (реакция немедленного типа) и спустя 24—48 ч (реакция замедленного типа). Очаговая аллергическая проба считается положительной при разнице в максимальных размерах зоны гиперемии кожи в месте введения герпетического и контрольного антигенов 5 мм и больше. Наибольшее разведение ИГВ, на введение 0,02 мл которой появилась положительная проба, считается пороговым. Используют внутрикожное введение порогового разведения препарата в объеме 0,1—0,2—0,4—0,8 мл и постепенно переходят на введение следующего разведения более высокой концентрации, а затем на нативную поливакцину с интервалом в 3 дня. Курс противорецидивной вакцинотерапии начинали не ранее чем через 2 нед. после завершения этапа подготовительного лечения. Необходимыми условиями для ее начала, помимо отсутствия клинических проявлений рецидива заболевания и нормализации показателей иммунограммы, были отсутствие острых инфекционных и неинфекционных заболеваний, стабильные социальные условия (спокойная и ровная обстановка в семье и на рабочем месте и т. д.). На основании этих критериев в указанные сроки для дальнейшего лечения были отобраны 40 пациенток, у которых в анамнезе были неудачные попытки противогерпетической вакцинации, причем у 14 (35 %) пациенток они предпринимались дважды. Из 1-й группы подготовительного этапа (больные получали фамвир) для вакцинации не отобрали никого, из 2-й группы (фамвир и амиксин) для вакцинации были отобраны 7 (17,5 %) больных, из 3-й (фамвир и циклоферон) — 12 (30 %) и из 4-й (фамвир и виферон) — 21 (52,5 %) человек. Наиболее эффективными были комбинации фам-вира и циклоферона либо фамвира и виферона. Анализ результатов вакцинации 40 пациентов (с частотой обострений до лечения 1 раз в 3—4 нед.) на протяжении 6 мес. наблюдения показал, что у 23 (57,5 % ) из них в течение последующих 3 мес. рецидивов ГГ не было. Полученный клинический эффект можно расценивать как «значительное улучшение» (увеличение межрецидивного периода в 3 раза). Спустя 5 мес. обострение инфекционного процесса (который приобрел абортивный характер) зарегистрировано лишь у 2 (5 %) больных: полностью отсутствовали продромальные явления, субъективно отмечено чувство дискомфорта в местах высыпаний. Количество пузырьковых элементов не превышало 1, а сам рецидив купировался самостоятельно в течение 1 сут. Через 2 мес. после вакцинации у 11 (27,5 %) пациенток наблюдалось повторное появление герпетических высыпаний, что не сопровождалось выраженной субъективной симптоматикой; сыпь исчезала самостоятельно, в значительно более короткие сроки, чем до вакцинации. Это позволяет расценивать достигнутый клинический эффект как «улучшение». Следовательно, у 34 (85 %) больных проведенная вакцинотерапия способствовала явному улучшению течения заболевания, проявляющемуся в отсутствии рецидивов ГГ на протяжении следующих за вакцинацией 3 мес. — периода активных наблюдений (время адекватной оценки проведенного лечения). Спустя 6 мес. после вакцинации улучшение сохранялось у 21 (52,5 %) пациента. Важно отметить, что у больных зафиксировано увеличение длительности межрецидивного периода с 2 до 5 мес. и сокращение времени рецидива до 1—3 сут., что сопровождалось значительным уменьшением числа клинических проявлений обострения. И лишь у 6 (15 %) женщин проведенное лечение не способствовало развитию клинически значимого результата, т. е. наблюдалось «отсутствие эффекта». Включение фамвира в сочетании с ИФН и индукторами ИФН в комплексную терапию таких больных хотя и не оказывает выраженного влияния на купирование клинических проявлений общей фазы заболевания, но способствует оптимизации клеточного иммунного ответа, нормализации цитокинового профиля (по содержанию ИФН-у и ИЛ-4 в плазме крови), а также, возможно, поляризации иммунных реакций в сторону Th1 типа. В частности, установлено, что любая форма терапии приводила к существенному увеличению коэффициента ИФН-у/ИЛ-4. Однако дополнительно этот коэффициент увеличивался, если в схему комплексной терапии были включены иммунотропные препараты. Мы полагаем, что комплексная терапия оказывает корригирующее влияние на разные звенья иммунитета при ВПГ-инфекции, что является важным условием для проведения последующей вакцинотерапии, целью которой является активация клеточного иммунного ответа, его иммунокоррекция и специфическая десенсибилизация организма. Как отмечалось, CD4+ и CD8+ Т-лимфоциты вместе с CD16+ НК-клетками вносят основной вклад в формирование протективно-го иммунитета на разных стадиях ВПГИ, а также при проведении специфической вакцинотерапии. Мы изучали влияние вакцинации ИГВ «Витагерпавак» на динамику показателей CD4+ и CD8+ Т-лимфоцитов, CD16+ НК-клеток, а также содержание в плазме периферической крови ИФН-у и ИЛ-4 (табл. 134). После вакцинации достоверно увеличивалось количество лейкоцитов и общих CD3+ Т-лимфоцитов периферической крови, достоверно повышались уровни ИФН-у, в то время как содержание ИЛ-4 было достоверно снижено. Данные изменения в содержании обоих цитокинов отразились на их соотношении друг к другу (коэффициент ИФН-у/ИЛ-4). В частности, коэффициент ИФН-у/ИЛ-4 достоверно увеличился после вакцинотерапии, что, очевидно, обусловлено синергидным повышением продукции ИФН-у с одновременным снижением ИЛ-4. Следовательно, происходило не только усиление Tx1-зависимых иммунных реакций, но и значительное подавление Тх2-зависимых иммунных процессов; а последние, как известно, не ассоциированы с протективным иммунитетом как при лечении рецидивов ВПГИ, так и при вакцинотерапии. Таким образом, можно полагать, что эффективность проведения профилактической вакцинотерапии определяется не только применением разработанной схемы вакцинации, но и правильным выбором комплексной терапии на подготовительном этапе. После вакцинотерапии содержание CD4+ и CD8+ Т-лимфоцитов в периферической крови пациентов достоверно повышалось по сравнению с исходными показателями (см. табл. 134), но не превышало, однако, уровней здоровых лиц. Интересно также, что для подавляющей части пациентов до проведения вакцинотерапии величины содержания обоих типов лимфоцитов уже находились в пределах нормальных величин. Вероятно, это обусловлено нормализующим эффектом комплексной терапии на подготовительном этапе. Достоверно (р < 0,05) увеличивалось содержание CD25+ иммунных клеток, что может рассматриваться в качестве маркера неспецифической активации T- и В-лимфоцитов, а также НК-клеток. С другой стороны, возможно, это может быть признаком увеличения количества CD4+CD25+ регуляторных Т-лимфоцитов, которые ограничивают чрезмерные иммунные реакции. Повышение после вакцинации содержания CD16+ НК-клеток также имеет благоприятное значение, поскольку эти клетки играют важную неспецифическую роль в ограничении репликации латентного ВПГ в ходе вакцинации. Суммируя эффект профилактического использования вакцины «Витагерпавак» по аллергометрической методике на главные звенья клеточного иммунитета, которые ассоциированы с протекцией при ВПГ-инфекции, можно заключить следующее: — вакцинотерапия индуцирует выраженное повышение содержания CD4+ и CD8+ Т-лимфоцитов в периферической крови пациентов, что может быть обусловлено их антиген-специфической пролиферацией в периферических тканях; — достоверное увеличение содержания CD16+ НК-клеток может свидетельствовать об усилении их миграции к очагам презентации антигенов вакцины и/или местам реактивации вируса для неспецифического контроля за его репликацией; — достоверное повышение содержания ИФН-у с одновременным снижением ИЛ-4 в сыворотке крови пациентов после вакцинотерапии указывает на поляризацию иммунных процессов в сторону Tx1-зависимых иммунных реакций (по соотношению молярных эквивалентов их концентраций в сыворотке периферической крови); — клиническая эффективность проведения вакцинотерапии может быть обусловлена преобладанием клеточных реакций иммунитета, что обусловлено усилением Txl-зависимых и подавлением Тх2-зависимых иммунных реакций. He отмечалось каких-либо пост-вакцинальных реакций общего или местного характера сразу после введения вакцины, а также за весь последующий 6-месячный период наблюдений. Таким образом, полученные результаты позволяют утверждать, что проведение противорецидивной вакцинотерапии ИГВ «Витагерпавак» возможно даже у пациентов с тяжелым течением ГГ с монотонным типом рецидивирования, причем рекомендуется выбор максимально низких доз вводимой противогерпетической вакцины (так называемая рабочая доза, снижение вирусной нагрузки). Для повышения эффективности вакцинотерапии необходима предварительная подготовка больного (фармакологическая премедикация вакцинального процесса) с назначением комплексной терапии — сочетанное использование противогерпетических ХП с ИФН или индукторами ИФН, т. е. препаратов с разнонаправленными механизмами действия, что обеспечивает синергидный и аддитивный эффекты. Впервые предложенные изменения лечебно-профилактической тактики для больных РГГ с монотонным типом рецидивирования (2 этапа лечения) способствуют уменьшению частоты и сроков рецидивов заболевания, улучшению качества жизни и повышению уровня социальной адаптации пациентов. | |
|
| |
| Всего комментариев: 0 | |