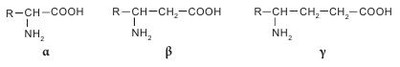10:48 Аминокислоты и протеины | |
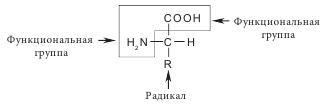
В растениях белковые вещества содержатся обычно в меньшем количестве, чем углеводы, но играют важную роль, поскольку белки составляют основную массу протоплазмы, почти все ферменты имеют белковую природу (за исключением рибозимов). В питании человека и животных белки имеют огромное значение. Аминокислоты — соединения, содержащие в составе своей молекулы одновременно амино- (-NH2) и карбоксильную (-СООН) группы. Известно около 1000 аминокислот, в организме человека их содержится более 60, но в состав белков входят только 20, они называются протеиногенными (белковыми). Общую формулу аминокислот можно представить следующим образом:
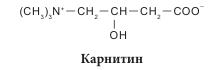
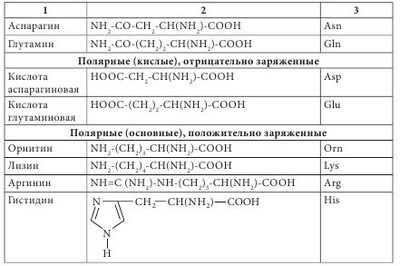
Аминокислоты классифицируются несколькими способами в зависимости от признака, по которому происходит их деление на группы. Принято три классификации: структурная — по химическому строению радикала; электрохимическая — по кислотно-основным свойствам; биологическая (физиологическая) — по степени незаменимости аминокислот для организма человека. По химической природе остатка R аминокислоты делятся на алифатические (ациклические) и циклические. Алифатические (ациклические) аминокислоты в зависимости от количества амино- и карбоксильных групп делятся на моноаминомонокарбоновые, диаминомонокарбоновые, моноаминодикарбоновые, диаминодикарбоновые. В зависимости от наличия той или иной группы в радикале алифатические аминокислоты подразделяют на гидрокси-, серо-, амидосодержащие и т. д. Циклические аминокислоты разделяют на ароматические (карбоциклические) и гетероциклические, к которым относятся также иминокислоты. Аминокислоты классифицируются по тому же принципу, что и все бифункциональные соединения — в зависимости от взаимного положения -NH2 и -COOH функциональных групп по углеводной цепи. То есть существуют а-, в-, у-аминокислоты и т. д. Основная масса аминокислот представлена а-изомерами; в-и у-аминокислоты в живых системах представлены единичными случаями. Здесь можно вспомнить тормозящий нейромедиатор ЦНС млекопитающих — кислоту у-аминомасляную (ГАМК) и Р-аланин, который является фрагментом кислоты пантотеновой — составной части кофермента А. Представителем природной у-аминокислоты является карнитин (бетаин кислоты 2-гидрокси-4-триметиламиномасляной), обозначается иногда как витамин К. Карнитин в значительных количествах присутствует в мышцах животных, бактериях и растениях, является фактором роста некоторых насекомых.
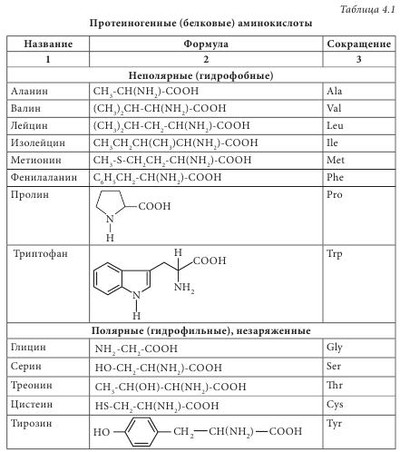
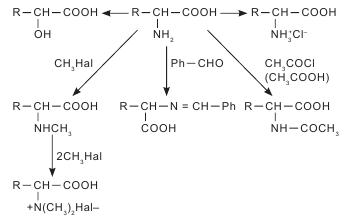
Чаще всего аминокислоты имеют тривиальное название. Для аминокислот характерны исторические названия. Происхождение названий аминокислот связано со свойствами и названием продуктов, из которых они впервые были выделены. Так, глицин имеет сладкий вкус (от греч. glikeros — сладкий), цистин (продукт окислительной димеризации цистеина) выделен из камней желчного пузыря (от греч. cystis — пузырь), лейцин (от греч. leukos — белый) получен из молочного белка — казеина; кислота аспарагиновая выделена из ростков спаржи (от греч. asparagos — спаржа), серии (от греч. sericon — шелк) был выделен из серицина шелка. Химическая номенклатура аминокислот построена в соответствии с правилами, разработанными Международным союзом чистой и прикладной химии (International Union Pure and Applied Chemie — IUPAC), согласно которым название соединения однозначно отражает его структуру. Аминокислоты очень широко представлены в живых организмах — в растениях, микроорганизмах, животных. Основная структурная особенность аминокислот — наличие асимметричного центра — атома углерода, при котором находятся -NH2 и -COOH группы. Это означает, что все аминокислоты, за исключением глицина, могут существовать в виде пары L- и D-оптических изомеров. Из пар антиподов молекулы а-аминокислот в жизнедеятельности организмов практически всегда фигурируют только L-изомеры, то есть организм синтезирует и потребляет исключительно L-а-аминокислоты. Среди них прежде всего выделяются генетически кодированные (протеиногенные) аминокислоты, которые включаются в состав белков под контролем информационной РНК. Нестандартными следует считать аминокислоты, которые имеют D-конфигурацию. Эти аминокислоты, как правило, входят в состав полипептидных антибиотиков и бактериальных клеточных стенок. Были обнаружены D-валин, D-фенилаланин, D-цистеин. D-аминокислоты являются компонентами стенок многих бактерий — это D-аланин, D-глутамин. В природных источниках аминокислоты встречаются в индивидуальном состоянии, в соединениях с несколькими молекулами различной химической природы (как правило, это антибиотики, коферменты), в сочетаниях между собой нескольких аминокислот (пептиды) и в виде биополимеров (белков). В зависимости от свойств радикала их классифицируют: - на углеводородные аминокислоты (глицин, аланин, валин, лейцин, изолейцин), для которых характерны гидрофобность или липофильность; - ароматические аминокислоты (фенилаланин, тирозин, триптофан), которые имеют тенденцию к реакциям электрофильного замещения; - аминокислоты с повышенными кислотными свойствами (аспарагиновая и глутаминовая). - аминокислоты с повышенной основностью (лизин, гистидин, аргинин); - аминокислоты, содержащие спиртовые и амидные группы (серии, треонин, аспарагин, глутамин), они легко образуют водородные связи, сложные эфиры и пептидные фрагменты; - группа аминокислот (цистеин, метионин, таурин), содержащих S, для которых характерна высокая нуклеофильность по атому серы, а для цистеина еще и способность окисляться до соответствующей дисульфидной кислоты. Отдельно следует выделить аминокислоту пролин. Это единственная аминокислота со вторичной -NH2 группой, входящей в циклический фрагмент. По электрохимическим (кислотно-основным) свойствам аминокислоты разделяют на три группы: кислотного характера — с дополнительными карбоксильными группами в боковом радикале (моноаминодикарбоновые кислоты: аспарагиновая и глутаминовая); основного характера — диаминомонокарбоновые: лизин и аргинин, гистидин; нейтральные — остальные. Современная рациональная классификация аминокислот основана на полярности радикалов, их способности к взаимодействию с водой при физиологических значениях pH=7,0. Эта классификация содержит четыре группы: неполярные (гидрофобные), боковые радикалы которых не имеют родства с водой (аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан); полярные (гидрофильные) незаряженные (глицин, серин, треонин, цистеин, тирозин, аспарагин, глютамин); полярные отрицательно заряженные (кислоты аспарагиновая и глутаминовая); полярные положительно заряженные (орнитин, лизин, аргинин, гистидин) (табл. 4.1). По биологическому (физиологическому) значению аминокислоты подразделяют на три группы: незаменимые (экзогенные), которые не могут синтезироваться в организме из других соединений, поэтому должны обязательно поступать с пищей (их для человека восемь: треонин, метионин, валин, лейцин, изолейцин, лизин, фенилаланин, триптофан); полузаменимые — могут образовываться в организме, но в недостаточном количестве, поэтому частично необходимо их наличие в белках пищи (для человека таких три: аргинин, тирозин, гистидин); заменимые (эндогенные) — синтезируются в организме в достаточном количестве из незаменимых аминокислот и других соединений (кислота глутаминовая, глицин, кислота аспарагиновая, серии, цистеин, тирозин, аланин, пролин, орнитин). По особенностям биосинтеза протеиногенные аминокислоты делятся на пять групп: - аминокислоты, происходящие из пирувата (лейцин, изолейцин, аланин, валин, лизин); - аминокислоты, происходящие из оксалоацетата (кислота аспарагиновая, аспарагин, треонин, метионин); - аминокислоты, происходящие из 2-оксоглутарата (аргинин и пролин); - аминокислоты, образующиеся из продуктов цикла Кальвина (глицин, серии, цистеин); - аминокислоты, происходящие из шикимата (триптофан, тирозин и фенилаланин). Кроме протеиногенных (белковых) аминокислот, в связанном (но не в составе белков) и в свободном состоянии обнаружено большое количество непротеиногенных аминокислот (4-гидроксипролин, е-N-метиллизин, 3,3'-дитирозин). Многие из них имеют различные виды биологической активности, например, кислоты у-метилен-К-глутаминовая и 2-амино-4-метилгексо-4-еновая являются мощными гипогликемическими агентами, кислота 1-аминоциклопропанкарбоновая — биологический источник этилена в растениях. Только в высших растениях их насчитывается более 200, значительное количество таких аминокислот производят микроорганизмы. Протеиногенные аминокислоты в растениях выполняют следующие функции: - транспортная функция азота по растению. В бобовых растениях, растущих в зоне умеренного климата, доминирующую роль в транспорте азота по растению играют аспарагин и глутамин. В тропических бобовых такую функцию выполняет аллантоин, или кислота аллантоиновая, в древесных породах — аргинин, в арахисе — метиленглутамин; - основная функция накопления азота и серы в семенах. Например, в зрелых семенах бобового растения канавалии (Canavalia) на долю непротеиногенной аминокислоты канаванина приходится 8% массы сухого вещества. Замечено, что у растений, в которых азот запасается в форме NO3-, значительно снижено содержание непротеиногенных аминокислот и наоборот. Как запасную серу растения откладывают S-метилцистеин; - быстрая и эффективная регуляция количества доступного NH4 для растения. Непротеиногенные аминокислоты легко подвергаются метаболизму и в случае необходимости поставляют в растение ионы азота для синтеза белков; - некоторые непротеиногенные аминокислоты участвуют в образовании протеиногенных. Например, из гомосерина образуется треонин и метионин; - защитная функция (например, орнитин и цитруллин участвуют в нейтрализации аммиака в орнитиновом цикле). По физическим свойствам аминокислоты — это бесцветные кристаллические вещества с высокой температурой плавления (более 250 °С), большинство из них растворимы в воде, малорастворимы в органических растворителях, преимущественно сладкие на вкус. Химические свойства аминокислот определяются наличием в их молекуле одновременно аминогруппы (-NH2) и карбоксильной группы (-СООН). Наличие аминогруппы обнаруживается в реакциях со щелочами (образуются карбоксилаты), со спиртами (образуются сложные эфиры), с аммиаком и аминами (образуются амиды кислот). а-Аминокислоты легко декарбоксилируются при нагревании или при действии ферментов. Эта реакция имеет важное физиологическое значение, поскольку ведет к образованию соответствующих биогенных аминов, которые выполняют ряд специфических функций в живом организме. Наибольшее значение среди них имеют коламин (2-аминоэтанол), холин, триптамин, адреналин, норадреналин, дофамин и др. Например, при декарбоксилировании гистидина образуется гистамин, оказывающий гормональное действие. В организме человека он содержится в связанном состоянии, высвобождается при воспалительных и аллергических реакциях, вызывает расширение капилляров, сокращение гладкой мускулатуры, резко повышает секрецию кислоты соляной в составе желудочного сока. В результате декарбоксилирования ароматического цикла аминокислоты триптофана образуется биогенный амин — серотонин. Он содержится в клетках кишечника человека, встречается в растениях (бананы, облепиха, кофе). Серотонин выполняет функции медиатора центральной и периферической нервной системы, влияет на тонус кровеносных сосудов, увеличивает количество тромбоцитов в крови, повышает устойчивость капилляров. Аминогруппы аминокислот проявляют себя в реакциях с кислотами, образовании аммонийных солей, ацилировании и алкилировании при взаимодействии с галогенангидридами и галогеналкилами, с альдегидами образуют основания Шиффа, с кислотой азотистой как первичные аминосоединения образуют соответствующие гидроксипроизводные (в данном случае гидроксикислоты).
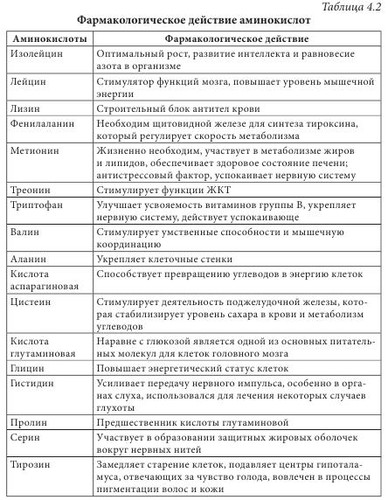
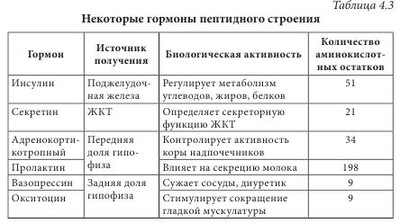
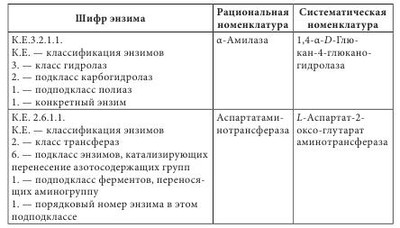
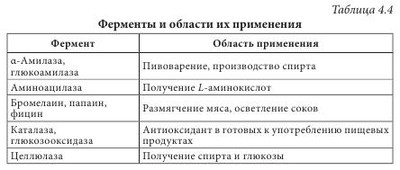
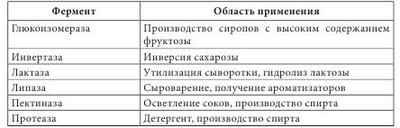
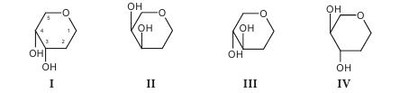
Высокая биологическая активность аминокислот способствует эффективному действию растительного сырья и полученных из него лекарственных средств на различные системы организма человека. Они имеют широкий спектр фармакологического действия (табл. 4.2). Многие аминокислоты широко применяются в различных отраслях хозяйства. Например, лизин, треонин, метионин и триптофан используются в животноводстве для обогащения кормов аминокислотами; лизин и натрия глутамат — в пищевой промышленности; кислота аминокапроновая является кровоостанавливающим лекарственным средством. Небелковые аминокислоты являются полупродуктами для синтеза лекарственных препаратов, красителей, комплексонов, поверхностно-активных веществ, сорбентов, содержащих лиганды. а-Аминокислоты (лактамы) используют для производства полиамидных волокон. Белками называют сложные высокомолекулярные соединения биологического происхождения (биополимеры), построенные из остатков аминокислот, соединенных пептидными связями. Они входят в состав практически всех клеточных составляющих растений, животных, микроорганизмов (ядер, мембран, цитоплазмы) и межклеточных структур. Белки чрезвычайно распространены в растительном и животном мире. Их отличает большое разнообразие. Условно вещества, которые содержат менее 50 аминокислотных остатков, называют полипептидами (или пептидами), а свыше 50 — белками. Пептиды линейного или циклического строения известны как гормоны, нейропептиды мозга, алкалоиды, регуляторные вещества, токсины, ферменты и т. д. (табл. 4.3). В свою очередь, пептиды подразделяют на низкомолекулярные и высокомолекулярные. Такие полипептиды характерны для животных организмов, наибольший интерес среди них представляют полипептиды, обладающие гормональной активностью. Большую группу биологически активных белковоподобных полипептидов составляют нейротоксины некоторых животных. Это яды низших морских червей, насекомых, змей и гадюк. Вторая группа полипептидов — разные по структуре соединения полипептидной природы с нетипичными для белков структурными особенностями. Среди них — образование пептидной связи карбоксильной или аминной группой боковой цепи; появление в составе полипептида а-аминокислоты D-конфигурации; включение в аминокислотную цепочку аминокислот небелковой природы; образование циклических структур и т. п. К этой группе полипептидов относят антибиотики пенициллин и цефалоспорин. Благодаря своему разнообразию белки классифицируют: - по составу (простые — протеины, сложные — протеиды); - происхождению (бактериальные, растительные, животные); - источнику выделения (мышечные, тканевые, сывороточные и т. п.); - физико-химическим свойствам (кислые, основные, нейтральные; полярные (гидрофильные), неполярные (гидрофобные), амфифильные (амфипатические)); - форме молекул (глобулярные — шаровидные, растворимые в воде; фибриллярные — нитевидные, в воде нерастворимы); - биологическим функциям и химическому строению (простые — апопротеины и сложные — голопротеины). Биологические функции белков: - структурная (являются основными компонентами клеточных мембран, соединительных и покровных тканей, волос, кожи и т. д.); - транспортная (питательные вещества (кислород, гормоны, липиды, атомы некоторых металлов, другие минеральные соединения) переносятся соединениями белковой природы); - каталитическая, или энзимная (биологические катализаторы, ускоряющие обмен веществ, имеют белковую природу); - гормональная (большинство гормонов, с помощью которых в организме осуществляется регулирование обмена веществ и физиологических функций, являются белками); - механико-химическая (движение цитоплазмы и органелл); - регуляторная (выступают фактором инициации синтеза полипептидов, обмена воды, поддержания онкотического давления в клетках); - защитная (стрессовые белки синтезируются в растении при воздействии неблагоприятных факторов); - запасная (до 10% энергии производится белками); - сигнальная (белки-рецепторы); - буферная (поддержка определенного значения pH в организме); - белки-токсины (значительное количество токсинов имеет белковую природу). Простые белки состоят только из остатков аминокислот, а сложные, кроме аминокислот, содержат небелковый компонент — простетическую группу. Простые белки делятся на альбумины, глобулины, протамины, гистоны, проламины, глютелины и склеропротеины. Сложные белки бывают нуклепротеинами (простетические группы — кислоты рибонуклеиновая и дезоксирибонуклеиновая), фосфопротеинами (остатки кислоты фосфорной), липопротеинами (липиды), гликопротеинами (углеводы), хромопротеинами (пигменты, красители), металлопротеидами (некоторые металлы). Среди белковых препаратов широко в медицине применяются ферменты. Ферменты (энзимы) (лат. fermentum — закваска, брожение; лат. enzyma от греч. еп — в, внутри, zyme — закваска) — вещества белковой природы, которые являются катализаторами биохимических реакций, происходящих в живых организмах и играющих важную роль в процессах метаболизма. Ферменты участвуют в большинстве процессов, происходящих в организме — реакциях синтеза и распада веществ, процессах пищеварения и всасывания, освобождении энергии, обеспечивают координацию биохимических реакций. Нарушение синтеза или активности ферментов приводит к возникновению болезней. Термин «фермент» был предложен впервые в XVII в. Яном Баптистом Ван-Гельмонтом для веществ, ускоряющих превращение виноградного сока в вино. Другое название — «энзимы» было дано позже в связи со способностью дрожжей ускорять процессы приготовления теста, сыра, пива и других продуктов. В иностранной литературе чаще употребляется термин «энзимы». Первые исследования энзимов связаны с открытием К. Кирхгофом в 1814 г. воздействия клейковины проросшего зерна ячменя на гидролиз крахмала до глюкозы. А.Я. Данилевский одним из первых описал в 1826 г. ферменты трипсин и панкреатическую амилазу. В 1836 г. Т. Шван выделил пепсин. Дальнейшее развитие ферментологии связано с именами Ю. Либиха, Л. Пастера, М.М. Манассеиной, А.Н. Лебедева. В 1913 г. Г. Ментен и Л. Михаэлис выдвинули теорию механизма действия ферментов. В 1926 г. (год рождения ферментологии как науки) Д.Б. Самнер выделил кристаллическую уреазу и доказал ее белковую природу. В 1969 г. Р.Б. Меррифильд (Нью-Йорк) синтезировал искусственную рибонуклеазу. Большинство ферментов по химическому строению — это молекулярные комплексы сложных белков, содержащих белковую и небелковую части. Такие энзимы называют голоэнзимами (голоферментами). Небелковые компоненты энзимов называются кофакторами. В отличие от энзимов, кофакторы стабильны при достаточно высоких температурах. Белковая составляющая энзимов без кофактора называется апоэнзимом (апоферментом). Она имеет низкую каталитическую активность или вообще неактивна. Скорость каталитической реакции в присутствии ферментов во многом зависит от наличия активаторов или ингибиторов процесса, которые вместе называются модуляторами энзимов. Функция активатора энзима заключается в переводе его в активную форму, способную катализировать реакцию. Активаторами чаще всего становятся неорганические ионы (катионы) K+, Са++, Zn++, Mg++, Мn++. Действие соответствующих ингибиторов ферментов противоположно действию активаторов. Если проводить аналогию с другими соединениями белковой природы, то энзимам свойственны разные уровни организации: первичный, вторичный, третичный и четвертичный. При этом основу строения фермента определяет вторичная структура в виде а-спиралей или в-структур. До сих пор известно более 3000 энзимов с молекулярной массой от нескольких тысяч до миллионов дальтон. Для большинства из них установлена природа, а для некоторых и химическая структура. В энзимологии приняты три типа номенклатуры — систематическая, рациональная и тривиальная. Названия ферментов по систематической номенклатуре состоят из названия субстрата и указания типа реакции, которую катализирует фермент, с добавлением окончания -аза. По рациональной номенклатуре название фермента образуется в упрощенном варианте из двух частей — природа субстрата, на который он действует, и типа химических реакций с добавлением окончания -аза. Например, энзим гидролиза лейцин-фенилаланина на составляющие аминокислоты называется лейцин-фенилаланингидролазом. В практической работе чаще используются названия энзимов по рациональной номенклатуре. Кроме того, широко используются тривиальные (исторические) названия ферментов (трипсин, химотрипсин, каталаза, липаза и др.), которые не отражают специфику их строения и действия. По современной классификации ферментов IUPAC/IUB они делятся на шесть классов в зависимости от типа реакций, которая активируется, и природы субстрата: 1 класс — оксиредуктазы — катализируют окислительно-восстановительные реакции; 2 класс — трансферазы — катализируют перенос химических групп, атомов или свободных радикалов с одного соединения на другое или в другие положения одного соединения; 3 класс — гидролазы — катализируют реакции гидролиза сложных молекул на более простые молекулы под действием воды; 4 класс — лиазы — катализируют реакции негидролитического расщепления с образованием двойных связей или присоединения соответствующих химических групп к двойной связи; 5 класс — изомеразы — катализируют реакции изомеризации; 6 класс — лигазы (синтетазы) — катализируют реакции синтеза с использованием энергии пирофосфатных связей АТФ и подобных соединений. Классы энзимов делятся на подклассы, а дальше на подподклассы. Подкласс уточняет основной вид субстрата, на который действует фермент, а подподкласс указывает на химическое строение субстрата или акцептора, участвующих в реакции. Для каждого энзима существует четырехкодовый шифр, цифры которого разделены точками. Первая цифра означает класс, вторая — подкласс, третья — подподкласс, четвертая — порядковый номер конкретного фермента в подподклассе. Перед цифрами ставятся буквы К.Е. (С.Е.) — классификация ферментов. Например: Ферменты как белки-катализаторы имеют ряд уникальных свойств. Это прежде всего необычайно высокая каталитическая активность. Другим важным свойством является избирательность действия. В некоторых случаях ферменты имеют абсолютную специфичность, катализируют превращение только одного вещества. Эта специфичность проявляется и в отношении условий реакции. По решению Международного биохимического союза принята стандартная единица активности фермента. За единицу активности (Е или U) любого фермента принимают такое его количество, которое катализирует превращение 1 микромоля субстрата за 1 минуту при заданных стандартных условиях. Активность определяется при температуре 30 °С, остальные параметры реакции индивидуальны для каждого фермента. В клетках растений присутствуют две категории ферментов: - конститутивные ферменты — обязательные компоненты растительной клетки; - адаптивные — синтезируются заново или их образование резко усиливается вследствие адаптации растительного организма к условиям окружающей среды (нитратредуктаза, гидроксил-аминредуктаза — их синтез значительно усиливается при введении в ткани растений нитрата или гидроксиламина соответственно). Ферменты располагаются в субклеточных структурах (органеллах) в соответствии с их функциями. Например: а) в ядре содержатся ферменты преобразования нуклеиновых кислот; б) во внутренней мембране митохондрий — ферменты дыхательной цепи; в) в лизосомах — гидролазы; г) в цитоплазме — ферменты гликолиза, синтеза жирных кислот; д) в матриксе митохондрий — ферменты ЦТК, окислительного декарбоксилирования а-кетокислот, в-окисления жирных кислот; е) плазматическая мембрана содержит ферменты транслоказы, которые переносят через мембрану ионы Na+, K+, глюкозу, аминокислоты и т. д. Физико-химические свойства Все ферменты, за исключением липазы, растворимы в воде. Их активность зависит от значения pH среды (для липазы — 8-9,5, для пепсина — 1,5) и температуры (около 40 °С). Источником получения ферментов являются органы и ткани животных (62%), растительное сырье (5%) и ферменты, продуцируемые микроорганизмами (33%). Сырьем животного происхождения являются поджелудочная железа (препараты трипсин, химотрипсин, панкреатин и т. д.), слизистая оболочка желудка (пепсин, пепсидил и т. д.), легкие, сердце и семенники крупного рогатого скота (цитохром С, лидаза, ронидаза), желудочный сок собак и лошадей и т. д. Продуктами жизнедеятельности микроорганизмов — а-амилаза, L-аспарагиназа, ораза и т. д. Растительным сырьем являются папайи латекс, ананаса плоды, арбуза семена. В промышленности энзимы преимущественно получают из культуральных жидкостей и клеток микроорганизмов, растительных и животных тканей экстракцией растворами солей. После выделения их разделяют на определенные фракции и осаждают с помощью неорганических солей, например (NH4)2SO4, или органических растворителей. На завершающих стадиях чистые энзимы выделяют методами аффинной или иммунно-адсорбционной хроматографии. Издавна энзимы использовались для выпечки хлеба, приготовления сыров, пива, вина. Кроме того, их применяют в производстве индивидуальных аминокислот или их смесей для искусственных продуктов питания, сахаристых веществ в производстве сиропов, некоторых лекарственных средств (табл. 4.4). В последнее время практическое значение приобрели иммобилизованные ферменты на полимерных носителях (подложках). К ним относятся энзимные системы, в которых молекула фермента связана с носителем (матрицей) полимерной природы. При этом энзимная составляющая может быть связана с носителем ковалентными, ионными, водородными, гидрофобными связями. В качестве полимерных носителей чаще всего используют целлюлозу, декстриновые гели (агарозу, сефарозу), кремнезем, а также синтетические полимеры (полиакриламид, поливиниловый спирт и др.). В фармацевтической промышленности растительные ферменты широко используются при производстве ферментных препаратов, пищевых добавок. Например, в состав фестала входит гемицелюллаза, которая осуществляет расщепление клетчатки. Ферментные препараты используются при лечении расстройств пищеварения, эндокринной недостаточности поджелудочной железы (панкреатические ферменты), для растворения желчных камней (папаин, бромелаин, панкреатические ферменты в сочетании с целлюлазой); при лечении гнойно-воспалительных процессов тканей и костей, при ожогах, в травматологии и ортопедии (протеаза, коллагеназа и гиалуронидаза); при лечении рубцов и контрактур (гиалуронидаза); в оториноларингологии при дифтерии, тонзиллите, ларингите, отите, в стоматологии при пародонтозе; при лечении тромбозов и тромбофлебитов (протеолитические ферменты трипсин и химотрипсин); в онкологии (L-аспарагиназа, глутаминаза, аргиназа, аргининдекар-боксилаза). Многие СПП содержат папаин и бромелаин, способные расщеплять белковые, жировые и углеводные компоненты пищи. Иммобилизованные энзимы (ферменты, закрепленные на носителе, но сохранившие каталитическую активность) используются в производстве L-аминокислот (аланина, серина, кислоты аспарагиновой), кислоты 6-аминопенициллановой; для получения лактозы из продуктов питания, предназначенных для больных с лактозной недостаточностью, для создания аппаратов «искусственная почка» и «искусственная печень»; при лечении для устранения действия некоторых токсинов; в анализе мочевины, глюкозы и т. д. Лектины (от лат. legere — собирать) — белки и гликопротеины со специфическими экологическими свойствами, способные избирательно связывать остатки углеводов на поверхности клеток, не вызывая их химического превращения. Лектины могут вызывать агглютинацию эритроцитов, а также обладают избирательной митогенной активностью в отношении различных субпопуляций клеток крови. Лектины нередко участвуют в клеточном распознавании. Например, некоторые патогенные микроорганизмы используют лектины для прикрепления к клеткам пораженного организма. Первый лектин был открыт доктором Г. Штильмарком (1860-1923) в Дерптском университете, он выделил белок из экстракта семян клещевины, исследовал его и назвал «рицин». Первым лектином, полученным в промышленных масштабах, был конканавалин А — белок из растения канавалия мечевидная — Canavalia ensiformis (L.) DC. семейства Бобовые — Fabaceae, который широко используется для очистки и характеристики сахаросодержащих молекул и клеточных структур. Лектины содержатся в различных организмах, при этом важным источником их получения являются растения. Лектины могут содержаться во всех органах растительного организма, однако чаще всего их получают из семян. Лектины составляют от 2 до 10% общего количества белков в бобовых растениях. В семенах клещевины, абруса, канавалии мечевидной, фасоли, гороха и других растений семейства Бобовые активность лектинов в семенах значительно выше, чем в других органах этих растений. Лектины могут находиться в клубнях, луковицах или корневищах: в корневищах крапивы — до 1 г/кг, купены — 250-340 мг/кг, луковицах однодольных — 50-500 мг/кг, Амариллисовых (подснежник, белоцвет, нарцисс), Лилейных (тюльпан, безвременник) и Луковых (чеснок), корневищах Ароидных. Также лектины найдены в листьях горошка однопарного (Vicia unijuga), побегах омелы белой (Viscus alba), в флоэмном соке Тыквенных (тыквы, дыни, огурца), в рыльце пестика примулы обратноконической (Primula obconica), в пыльце табака обыкновенного (Nicotiana tabacum), в спорах хвоща полевого (Equisetum arvense), в плодовых телах шампиньона и алеврии. В небольших количествах лектины содержатся в картофеле, пшенице, кукурузе, дурмане. У растений, грибов и животных концентрация лектинов сильно варьирует в зависимости от фазы вегетации растения, стадии развития организма или функционального назначения органа. В травянистых растениях максимальное количество лектинов достигается в период их интенсивного роста, как правило, весной (во время весеннего сокодвижения, развития листьев, роста соцветий), а также осенью во время созревания семян, во время цветения наблюдается минимальное количество. Во время роста листьев активность лектинов в растении снижается, а с началом полноценного функционирования вновь повышается, оставаясь постоянной в течение летнего периода и снижаясь осенью. Лектины в растениях выполняют следующие функции: - связанные с межклеточными отношениями (совместимость при оплодотворении, взаимодействие растений с симбиотическими и патогенными микроорганизмами, привлечение свободноживущих азотфиксирующих бактерий); - эндогенные функции (участие в организации белок-углеводных, белок-белковых и ферментных комплексов, участие в организации внутриклеточного матрикса, внутренне- и межклеточный сигналинг; регуляция деления, растяжения и дифференциации клеток, стимуляция прорастания и регуляторная роль в эмбриогенезе семян; защитная и транспортная функции). Лектины транспортируют углеводосодержащие вещества по флоэме, а также играют значительную роль в их накоплении в семенах. Они участвуют в адсорбции клубеньковых бактерий на корнях растений. Растительные лектины являются митогенами, они способны увеличивать плотность популяции бактерий, что очень важно при применении микробных препаратов. Установлено, что эти соединения положительно влияют на развитие почвенных микроорганизмов. Одним из проявлений биологической активности лектинов относительно бактерий является их влияние на рост, метаболизм и физиологическую активность бактериальных клеток. Кроме того, модуляторное действие этих веществ может проявляться в активации отдельных ферментов, в том числе нитрогеназы. Существует несколько подходов к классификации лектинов, в основу которых положены различные принципы. В 1957 г. М. Мекеле предложил одну из первых классификаций лектинов, основанную на их углеводной специфичности. Автор систематизировал данные о родстве лектинов с углеводами и сформулировал закономерности их взаимодействия в зависимости от структуры последних. Впоследствии были предложены смешанные классификации, в основу которых положены следующие критерии: - происхождение: лектины растений (фитолектины), грибов (миколектины), бактерий, вирусов (бактолектины) и животных (зоолектины — морские беспозвоночные, икра рыб, яд змей, виноградная улитка); связанные и не связанные с мембранами клеток; лектины, специфические для органа, ткани или клеток определенного живого организма и т. д.; - биологическая активность: эритроагглютинины; лейкоагглютинины; митогены; агглютинины половых клеток; токсины; бифункциональные лектины; - строение молекулы: чистые белки; гликопротеины (когда содержание углеводов в составе молекулы менее 50%); протеогликаны (содержание углеводов составляет 50-60%), металлопротеины (когда в составе лектина присутствуют ионы металла, необходимые для проявления его активности); по числу субъединиц, входящих в состав молекулы (мономеры, димеры, тетрамеры и молекулы с большим числом субъединиц); - углеводная специфичность (реагируют с кислыми или нейтральными сахарами) и структура доменов углеводного распознавания (присоединяются к конечным остаткам, к конечным ди- и тетрасахарам, к олигосахарам внутренних областей цепей). По углеводной специфичности различают четыре основных группы с разным положением ОН-групп при атомах C3 и C4 в пиранозном цикле: К I группе относится, например, остаток L-фукозы, ко II — D-галактозы, к III — D-маннозы и D-глюкозы, в IV — L-ксилозы. Известные лектины дифференцируют первые три группы углеводов; лектины, специфичные к углеводам, содержащим остатки четвертой группы моносахаридов, не найдены. Важнейшей функциональной частью домена углеводного распознавания является центр, или место связывания углеводов. Углевод и лектин взаимодействуют по классической схеме энзим-субстратного взаимодействия. Однако, в отличие от ферментов-гликозидаз, они не вызывают химических превращений. Кроме того, гликозидазы моновалентные, а лектины в большинстве случаев имеют не менее двух центров связывания углеводов. В формировании активных центров лектинов участвуют аминокислоты белковой части молекулы. Важную роль во взаимодействии между лектином и углеводом играют свободные аминогруппы, карбоксильные группы аминокислот и две ароматические структуры: тирозин и триптофан. Свободные амино-и карбоксильные группы аминокислот формируют водородные связи с ОН-группами углерода. Лектины не имеют одинаковых структурных особенностей. Их молекулярная масса находится в пределах 5000-400 000 дальтон; молекулы содержат от 1 до 20 субъединиц. Большинство лектинов — гликопротеины, многие из них содержат координационно связанные Ca2+ и Mn2+, которые необходимы для проявления биологической активности. Для некоторых лектинов известна пространственная структура. Например, в бобовых эти белки, как правило, состоят из двух или четырех субъединиц с молекулярной массой 25 000-30 000 дальтон, которые содержат по одному углевод-связывающему центру. Большинство лектинов имеют несколько центров связывания углеводов, которые могут проявлять различную специфичность. Если они расположены на разных субъединицах, возможно образование нескольких изоформ с различными иммунохимическими и биологическими свойствами. Обнаружение лектинов в растительных экстрактах проводят с помощью реакции агглютинации суспензии частиц или клеток, на поверхности которых находятся углеводы. В качестве таких частиц чаще всего используются эритроциты (нормальные или обработанные протеолитическими ферментами), а также лейкоциты, лимфоциты, клетки опухолей, микроорганизмов и простейших, протопласты растений, углеводсодержащие липосомы. Кроме реакции агглютинации, для обнаружения лектинов используют реакцию преципитации между лектинами и рядом полисахаридов (например, декстран, гликоген, амилопектин, гуаран рожкового дерева), а также некоторыми синтетическими гликозидами. Лектины нашли практическое применение в некоторых узкоспециализированных медицинских отраслях, таких как гистология (выявление углеводородных структур на поверхности клеток и тканей, диагностика групп крови), диагностика иммунодефицитных состояний и выявление хромосомных нарушений, трансплантология (разделение клеток крови и лимфоидных клеток, отличных по антигенным свойствам; очистка крови от вирусов, патологически измененных гликопротеинов; целенаправленная доставка лекарств к нормальным или патологически измененным клеткам и тканям организма или к инфекционным агентам). Например, лектины моркови дифференцируют стрептококки полости рта, лектины зародышей пшеницы используют при идентификации гонококков и стрептококков, лектины манго и авокадо — при эпиданализе кампилобактериоза, клетки бацилл сибирской язвы агглютинируются под влиянием лектинов грифонии простолистой (Grifonia simplicifolia), сои щетинистой (Glycine max), абруса молитвенного (Abrusprecatorius), клещевины обыкновенной (Ricinus communis). | |
|
| |
| Всего комментариев: 0 | |